Komar D. - Médica Anestesióloga
(FAAAAR), Jefa del Serv. de Anest. del Hosp. de Pediatría (SAMIC)
"Prof. Dr. Juan P. Garrahan".
Martinaschi S. J. - Farmacéutico Becario (Beca R. Carrillo
-A. Oñativia).
Valora P. D. - Farmacéutico y Bioquímico, Jefe del
Area de Farmacia del Hospital de Pediatría (SAMIC) "Prof. Dr. Juan
P. Garrahan".
Sinissi M. - Anestesióloga (FAAAAR), Médica Principal
del Hospital de Pediatría (SAMIC) "Prof. Dr. Juan P. Garrahan"
Cáceres Guido P. A. - Farmacéutico del Hospital de
Pediatría (SAMIC) "Prof. Dr. Juan P. Garrahan"
Hospital de Pediatría (S.A.M.I.C.) "Prof. Dr. Juan P. Garrahan"
(Buenos Aires - Argentina).
Introducción
Luego de una anestesia general, es habitual la utilización de mezclas
analgésicas en el postoperatorio inmediato.
Existe gran variedad de las mismas, por lo que cuando comenzamos a utilizarlas
en nuestro Hospital los farmacéuticos, con criterio, nos preguntaron
como validábamos estas mezclas, en cuanto a la estabilidad de las
mismas con el correr de las horas y si la utilización conjunta
de distintos medicamentos en un mismo frasco no producía la formación
de algún compuesto por simple reacción química. De
hecho la literatura farmacéutica cita la incompatibilidad de algunas
de nuestras mezclas habituales.
El criterio clínico de efectividad del tratamiento es el parámetro
que seguimos utilizando en el Servicio de Anestesiología. Sin embargo
hemos comenzado a trabajar en forma conjunta con el Área de Farmacia
con el propósito de validar las mezclas que ya tenemos en uso,
y en el futuro, todas las que se implementen. En este trabajo analizaremos
la mezcla Ranitidina-Midazolam. La bibliografía 1, 2 y 3123 cita la
formación inmediata de turbidez blanquecina a concentraciones de
50 mg./ml y 5 mg./ml respectivamente. Dado que al mezclar dichas drogas
a concentraciones de 300 mcg/ml y 30 mcg/ml (concentraciones que se obtienen
cuando se coloca en un sachet de solución fisiológica 0,9%
de cloruro de sodio de 500 ml, 150 mg. de Ranitidina y 15 mg. de Midazolam)
no se observa la incompatibilidad antes mencionada, decidimos verificar
si se produce incompatibilidad física o química no observable
a simple vista. En el primer caso mediante la observación microscópica
óptica, buscando posible formación de cristales y para la
segunda mediante la evaluación de la estabilidad en el momento
de su preparación, así como también a las 24 horas
de preparada en el sachet de 500 ml en las concentraciones citadas.
Materiales y Métodos4
A) Se preparan las siguientes soluciones:
A1) Preparación del testigo de Ranitidina 300 µg/ml: Se colocan 3 ampollas de Ranitidina (150 mg.) en un matraz aforado de 500 ml y se lleva a volumen con solución fisiológica de cloruro de sodio 0,9 %, se homogeneiza durante 1 minuto.
A2) Preparación del testigo de Midazolam 30 µg/ml: Se coloca 1 ampolla de Midazolam (15 mg.) en un matraz de 500 ml y se lleva a volumen con solución fisiológica de cloruro de sodio 0,9%, se homogeniza durante 1 minuto.
A3) Preparación de la mezcla de Ranitidina-Midazolam (300 µg/ml-30 µg/ml): Se colocan 3 ampollas de Ranitidina y 1 ampolla de Midazolam en un matraz aforado de 500 ml y se lleva a volumen con solución fisiológica de cloruro de sodio 0,9 %, se homogeniza durante 1 minuto.
A4) Blanco para observación microscópica: Solución fisiológica 0,9 % de cloruro de sodio.
El estudio fue dividido en dos días, Día 1 (Hora Cero)
y Día 2 (Hora 24). Los análisis de las soluciones se realizaron
como se indica a continuación:
La solución A1 y A2 fue analizada por HPLC,
siendo preparadas nuevas el Día 1 y el Día 2.
La soluciones A3 fueron observadas microscópicamente
y analizadas por HPLC en el momento de su preparación (Día
1), así como también a las 24 horas (Día 2). Conservándola
en sachet de solución fisiológica, a temperatura ambiente.
- Para la observación microscópica se utiliza un microscopio
óptico con un aumento de 400 x. La mezcla se tratará de
la siguiente forma:
Una alícuota de 15 ml de la misma se centrifuga durante cinco minutos a 10.000 revoluciones por minuto (rpm), el líquido sobrenadante se descarta y se añade 0,1 ml de solución fisiológica 0,9 % agitando suavemente para lograr la resuspensión de los posibles cristales formados, luego se toma con la ayuda de una pipeta Pasteur una gota de este líquido y se la coloca sobre un portaobjeto cubriéndola con un cubreobjeto. Este mismo procedimiento se realiza para la observación del Blanco (solución fisiológica 0,9 %). - Para cuantificar las soluciones y la posible formación de algún producto en la mezcla se utiliza un equipo de HPLC (High Performance Liquid Chromatrography) con detector UV-VISIBLE "Agilent 1100 Series" (equipado con un inyector manual de 20 mcl) el cual permite al operador realizar la separación de las drogas de la mezcla y cuantificar la cantidad de las mismas mediante el análisis del área bajo la curva de cromatograma obtenido.
El sistema cromatográfico utilizado esta conformado por:
- Fase estacionaria: Fase reversa C18.
- Fase móvil: Acetonitrilo: Metanol: Solución Buffer de
PO4H2K regulada a pH = 7,4. (40: 20: 40)
- Temperatura de la corrida: temperatura ambiente (25 ºC)
- Velocidad de corrida: 1 ml/minuto
- l = 254 nm
- Volumen de inyección: 20 mcl.
A) Curva de calibración para la cuantificación de las correspondientes
drogas: dicha curva se realiza con el objetivo de verificar que el sistema
cromatográfico utilizado es lineal dentro del rango de concentraciones
que se esta trabajando.
Se realizaron soluciones de Ranitidina de las siguientes concentraciones:
100; 200; 300; 400; 500 mcg/ml en solución fisiológica de
cloruro de sodio 0,9 %. Las soluciones de Midazolam fuero de: 10; 20;30;
40; 60 µg/ml en solución fisiológica de cloruro de
sodio 0,9 %.
Estas soluciones se inyectaron por duplicado en el equipo de HPLC midiendo
automáticamente el área bajo la curva (ABC) del cromatograma
por integración valle a valle entre los picos y construyendo con
dichos datos la curva de calibración, la cual quedó expresada
como: Area Bajo la Curva en función de la Concentración
de Droga (ABC vs. Cp).
Así se pudo concluir que el método es lineal en los rangos
de concentración antes mencionados (Fórmula de Regresión:
y = 22,178x + 136,52 [R2 = 0,9998], Coeficiente de Variación f
(%)=1,320), de esta forma se establece que existe una relación
directamente proporcional entre el ABC arrojada por el integrador automático
del equipo HPLC (Ley de Lambert-Beer). También se analizó
la Variabilidad Intradía CV f (%) = 0,546 y la Variabilidad Interdía
CV f (%) = 0,726.
Análisis de los resultados
1- Determinación crotográfica por HPLC:
| TABLA 1 Relación entre Tiempos de retención, Área Bajo la Curva para los tres ensayos de los testigos por triplicado |
|||||||
| TESTIGOS | |||||||
| HORA CERO | HORA 24 | ||||||
| Ranitidina (300mcg/ml) | Midazolam (30mcg/ml) | Ranitidina (300mcg/ml) | Midazolam (30mcg/ml) | ||||
| Tiempo de Retención (minutos) | Area (mA) | Tiempo de Retención (minutos) | Area (mA) | Tiempo de Retención (minutos) | Area (mA) | Tiempo de Retención (minutos) | Area (mA) |
| ENSAYO 1 | |||||||
| 1,903 | 6711,8 | 6,044 | 1237,5 | 1,919 | 6881,4 | 6,488 | 1360,0 |
| 1,917 | 6745,5 | 6,062 | 1291,2 | 1,916 | 6737,5 | 6,473 | 1421,3 |
| 1,906 | 6742,6 | 6,091 | 1314,9 | 1,917 | 6767,5 | 6,486 | 1429,0 |
| ENSAYO 2 | |||||||
| 1,914 | 7137,9 | 6,384 | 1483,7 | 1,889 | 6799,4 | 5,969 | 1371,0 |
| 1,916 | 7042,4 | 6,384 | 1426,0 | 1,891 | 6767,3 | 5,963 | 1393,3 |
| 1,916 | 7041,5 | 6,406 | 1487,4 | 1,890 | 6765,7 | 5,985 | 1431,3 |
| ENSAYO 3 | |||||||
| 1,898 | 6767,9 | 6,180 | 1876,3 | 1,935 | 6709,9 | 6,180 | 1376,0 |
| 1,912 | 6805,3 | 6,188 | 1922,0 | 1,900 | 6594,1 | 6,189 | 1390,7 |
| 1,891 | 6786,1 | 6,200 | 1927,3 | 1,949 | 6653,2 | 6,199 | 1402,5 |
| Gráfico de corrida para el testigo de Ranitidina (300 mcg/ml) por HPLC |
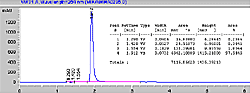 [ Ampliar imagen ] |
| Gráfico de corrida para el testigo de Midazolam (30 mcg/ml) por HPLC |
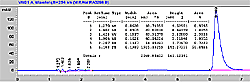 [ Ampliar imagen ] |
| TABLA 2 Relación entre Tiempos de retención, Area Bajo la Curva para los tres ensayos de la mezcla por triplicado |
|||||||
| MEZCLA | |||||||
| HORA CERO | HORA 24 | ||||||
| Ranitidina | Midazolam | Ranitidina | Midazolam | ||||
| Tiempo de Retención (minutos) | Area (mA) | Tiempo de Retención (minutos) | Area (mA) | Tiempo de Retención (minutos) | Area (mA) | Tiempo de Retención (minutos) | Area (mA) |
| ENSAYO 1 | |||||||
| 1,908 | 6320,3 | 6,108 | 1329,3 | 1,900 | 6781,1 | 6,008 | 1391,4 |
| 1,912 | 6592,1 | 6,123 | 1344,6 | 1,871 | 6588,6 | 5,923 | 1300,4 |
| 1,909 | 6602,0 | 6,147 | 1288,0 | 1,875 | 6592,5 | 6,009 | 1298,8 |
| ENSAYO 2 | |||||||
| 1,898 | 6486,6 | 6,240 | 1275,9 | 1,928 | 6506,1 | 6,052 | 1385,7 |
| 1,906 | 6399,8 | 6,214 | 1252,5 | 1,879 | 6453,0 | 5,859 | 1369,4 |
| 1,906 | 6403,5 | 6,288 | 1341,3 | 1,885 | 6449,9 | 5,866 | 1365,7 |
| ENSAYO 3 | |||||||
| 1,901 | 6507,7 | 6,251 | 1234,9 | 1,904 | 6493,2 | 6,215 | 1378,3 |
| 1,902 | 6454,7 | 6,526 | 1372,0 | 1,909 | 6472,3 | 6,229 | 1377,4 |
| 1,922 | 6449,0 | 6,308 | 1277,2 | 1,911 | 6367,7 | 6,246 | 1317,9 |
| TABLA 3 Valores que relacionan el ABC, concentración y disminución del porcentaje de concentración para los testigos y la Mezcla en el momento de la preparación. |
||||||||||
| Testigo | Mezcla | |||||||||
| Ranitidina (300 mcg/ml) |
Midazolam (30 mcg/ml) |
Ranitidina | Midazolam | |||||||
| Hora cero | Area Promedio (mA) | Factor de Respuesta | Area Promedio (mA) | Factor de Respuesta | Area Promedio (mA) | CC (mcg/ml) | Dismin. CC (%) | Area Promedio (mA) | CC (mcg/ml) | Dismin. CC (%) |
| E 1 | 1281,2 | 6504,8 | 1320,6 | |||||||
| E 2 | 7073,9 | 1465,7 | 6430,0 | 1289,9 | ||||||
| E 3 | 6733,3 | 1281,2 | 6470,5 | 1294,7 | ||||||
| Prom | 6846,8 | 0,04382 | 1342,7 | 0,02234 | 6468,4 | 283,4 | 5,5 | 1301,7 | 29,1 | 3,0 |
| E = Ensayo | ||||||||||
| Ranitidina Gráfico de corrida para la mezcla: Ranitidina (300 mcg/ml) - Midazolam (30 mcg/ml) por HPLC |
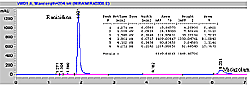 [ Ampliar imagen ] |
| TABLA 4 Valores que relacionan ABC, concentración y disminución del porcentaje de concentración para los testigos, preparados en el momento, y la Mezcla a las 24 horas de su preparación |
||||||||||
| Testigo | Mezcla | |||||||||
| Ranitidina (300 mcg/ml) |
Midazolam (30 mcg/ml) |
Ranitidina | Midazolam | |||||||
| Hora 24 | Area Promedio (mA) | Factor de Respuesta | Area Promedio (mA) | Factor de Respuesta | Area Promedio (mA) | CC (mcg/ml) | Dismin. CC (%) | Area Promedio (mA) | CC (mcg/ml) | Dismin. CC (%) |
| E 1 | 6795,5 | 1403,4 | 6454,1 | 1330,2 | ||||||
| E 2 | 6777,5 | 1398,5 | 6469,7 | 1373,6 | ||||||
| E 3 | 6652,4 | 1389,7 | 6444,4 | 1357,9 | ||||||
| Prom | 6741,8 | 0,04449 | 1397,2 | 0,02147 | 6456,1 | 287,2 | 4,3 | 1353,9 | 29,1 | 3,0 |
2- Observación microscópica óptica: Ausencia de cristales
Conclusiones
La observaciónmicroscópica no mostró formación de cristales, por lo que se descarta una posible interacción de características físicas de Ranitidina-Midazolam a concentraciones de Ranitidina de 300 mcg/ml y 30 mcg/ml. Esta diferencia respecto a la bibliografía o estudios antes mencionados puede deberse al gran volumen en el cual están disueltas dichas drogas.
Con relación a la evaluación de la estabilidad química de la mezcla, se la considera estable tanto al momento de su preparación, como también a las 24 horas, dado que los valores de concentraciones de Ranitidina y Midazolam aparecen dentro de los límites aceptados de estabilidad, con una disminución menor al 10 % de la concentración de Ranitidina y Midazolam cuando se los disuelve por separado en solución fisiológica 0.9 % de cloruro de sodio (Testigos). Esto se observa en las tablas 3 y 4 donde los valores de disminución de la concentración de Ranitidina y Midazolam son de 5,5 % y 3 % para Hora cero y 4,3 % y 3 % para Hora 24.
Bibliografía
- Forman JK & Souney PF: Visual compatibility of midazolam hydrochloride with common preoperative injectable medications. Am J Hosp Pharm 1987; 44:2298-2299.
- Handbook on Injectable Drugs ASHP Trissel (1996).
- Micromedex ® Healthcare Series Integrated Index. 2003.
- Ruiz Caldes, M.J., San Martín Ciges, E., Ezquer Borras, J., Rodilla Calvelo, F., Ferriols, F. Hospital Clínico Universitario de Valencia (Farm Hosp. 1995; 19 (1):41-44).