E-mail: vero@coopenet.com.ar
Introducción
El síndrome de embolia grasa (SEG) es una asociación entre una disfunción pulmonar y cerebral, con hipoxemia y fiebre, presente en pacientes con politraumatismo y fractura de huesos largos1. Los primeros casos fueron descriptos en 1669 por Lower de Oxford, cuando describió la embolia grasa en perros luego de inyectarles leche; sin embargo, el reporte de la embolia grasa post-traumática fue realizado por Zenker en 1862. Cuatro años más tarde Busch publicó la asociación de la embolia con la lesión ósea, aunque corresponde a Von Bergmann el primer reporte clínico del SEG en el año 1873.(2)
(2) Factores de riesgo para el desarrollo del SEG
Factores clínicos
1. Pacientes jóvenes.
2. Politraumatismos con fracturas de huesos largos.
3. Postergación en la reducción y fijación de fracturas de huesos largos.
Factores anatómicos
1. Estrechez del canal medular.
2 . Enclavijamiento en canales de largo diámetro.
3 . Colocación de clavos medulares gruesos.
4 . Escariar un canal medular pequeño.
SEG: Síndrome de Embolia Grasa.
Criterios para el diagnóstico del SEG
- Criterios mayores
1. Injuria pulmonar (hipoxemia).
2. Deterioro neurológico (estupor, coma).
3. Deterioro hematológico (petequiado axilar, conjuntival, coagulopatía por consumo).
- Criterios menores
1. Taquicardia.
2. Hipertermia.
3 . Insuficiencia renal.
4 . Insuficiencia hepática.
5 . Hipertensión pulmonar moderada (constatada por catéter de Swan-Ganz).
SEG: Síndrome de Embolia Grasa.
Caso clínico
Paciente femenino de 53 años de edad con 70 kg de peso, que ingresa el día 12/06/97 al servicio de quirófano del H.I.G.A "Dr. José Penna", proveniente de la sala de internación, para ser sometida a una reducción quirúrgica de sus fracturas de fémur, tibia y peroné del miembro inferior derecho. A las 7:45 hs, la paciente ingresa a quirófano, se le toman controles de signos vitales registrándose: tensión arterial de 120/80 mmHg, frecuencia cardíaca de 87 latidos por minuto, frecuencia respiratoria de 15 por minuto. Posteriormente se le realiza venopunción con catéter de teflón N°16G en miembro superior izquierdo; no se administra ninguna medicación anestésica previa. Se la hidrata con solución fisiológica y, luego de haberle infundido 1000 ml, se procede a efectuar el bloqueo regional epidural en posición sentada, eligiéndose para la punción el espacio L3-L4, con aguja de Tuohy Nº 18G descartable. Se realiza comprobación de localización correcta de la punta de la aguja mediante la prueba de pérdida de resistencia; previa aspiración negativa se inyectan 3 cm³ de la solución de bupivacaína al 0,5% más fentanilo como dosis de prueba, que al ser negativa para inyección intravascular o subaracnoidea se completa la dosis calculada (bupivacaína al 0,5%: 90 mg, más 100 microgramos de fentanilo). Posteriormente se esperan 15 minutos, se constata el nivel del bloqueo sensitivo a través del test del pinchazo y luego se traslada a la paciente a la mesa quirúrgica, obteniéndose un bloqueo satisfactorio. Una vez colocados los campos quirúrgicos se inicia la cirugía.
La paciente sufre un descenso de aproximadamente el 20% de su tensión arterial de inicio, que se interpreta como consecuencia de la anestesia epidural. Durante la cirugía mantuvo estable sus parámetros vitales.
Luego de 75 minutos de cirugía la paciente comienza en forma súbita con disnea, taquipnea, taquicardia, hipotensión e hipoxemia constatada por oximetría de pulso, acompañada por posterior deterioro del sensorio; se procede a soporte ventilatorio con oxígeno al 100% y máscara mientras se cierra la incisión quirúrgica. Inmediatamente la paciente es transportada a la Unidad de Cuidados Intensivos (UCI).
Antecedentes
Politraumatismo con fracturas desplazadas de fémur, tibia y peroné derechos ocasionados por un accidente de tránsito. (ver figuras 1 y 2)
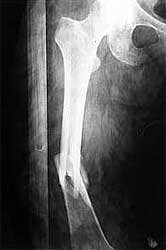 [ Ampliar imagen ] |
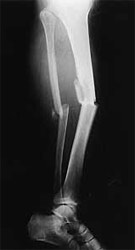 [ Ampliar imagen ] |
| Figura 1 | Figura 2 |
Examen físico
Paciente estuporosa con escasa respuesta a estímulos verbales. Glasgow: O:2-V:2-M:6 (10/15).
Mala perfusión periférica, taquipnéica, con deterioro de la mecánica respiratoria y rales crepitantes sobre campos pulmonares medios e inferiores bilaterales.
Signos vitales al ingreso a UCI
Tensión arterial: 150/80 mmHg
Frecuencia cardíaca: 150 por minuto
Frecuencia respiratoria: 50 por minuto
Laboratorio
Hematocrito: 22% - Rto. de glób. blancos: 18.800
PH: 7,09 - PCO2: 61 - PO2: 66 - Sat. O2: 83% - FiO2: 0,50.
Pa/FiO2:132
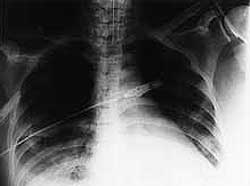
Rx tórax: (Fig. 3)
 [ Ampliar imagen ] |
| Figura 3 |
Discusión
Inicialmente el cuadro clínico se interpretó como un tromboembolismo pulmonar por sus signos y síntomas clínicos de inicio; después de colocado el catéter de Swan-Ganz se comprobó que la presión media de la arteria pulmonar se encontraba ligeramente aumentada (19 mmg), con presión de cuña (7 mmg) y presión en la aurícula derecha (10 mmg), por lo cual se descartó este diagnóstico.
El otro planteo, descartado el anterior, fue el de SEG, basado en el antecedente de fracturas de huesos largos, signos y síntomas clínicos en el intraoperatorio, el cual fue ratificado con el lavado broncoalveolar.
La embolia grasa es un síndrome con deterioro de la función pulmonar y cerebral con hipoxemia y fiebre, presente en pacientes con politraumatismo complicado con fracturas de huesos largos1,3,4, pudiendo asociarse a otras patologías no traumáticas (pancreatitis aguda, diabetes mellitus, quemaduras, reconstrucción de articulaciones, infusión parenteral de lípidos) en un 8,5 a 66%.2,3
Estadísticamente se observan más episodios de embolia grasa en adultos jóvenes debido a un mayor número de traumas, ocasionados principalmente por accidentes automovilísticos, siendo causa de considerable morbilidad.4 De acuerdo a lo observado en distintas publicaciones se pueden determinar los factores de riesgo que se enumeran en la tabla I. La incidencia es de un 10%1,2, mientras que la detección en las autopsias oscila alrededor del 31%, siendo mayor su diagnóstico en autopsias de pacientes traumatizados que en las de pacientes sin traumatismos.2,6 La mortalidad es del 10 al 35%, dependiendo de la magnitud de la disfunción multiorgánica, aumentando la misma cuando se asocia en una fase secundaria a una coagulación intravascular diseminada1,3,6. El SEG debe sospecharse cuando se asocia a deterioro cerebral, respiratorio y hematológico en pacientes con un marco clínico apropiado. Para su diagnóstico clínico se dispone de criterios mayores y menores1,2. (Tabla II.)
Si bien la embolización es inmediata, los síntomas aparecen después de un período de latencia de dos a tres días. La disfunción pulmonar caracterizada fisiopatológicamente por un shunt es la primera manifestación, apareciendo posteriormente el deterioro del estado mental, que coincide con episodios más graves del shunt.2,7 La disfunción cerebral y hematológica se encuentran en el 70 y el 40% de los casos respectivamente.3 Las manifestaciones pulmonares consisten en disnea de comienzo agudo, taquipnea e hipoxemia; mientras que el deterioro cerebral involucra a estados de inquietud, ansiedad, confusión e inclusive hasta el coma. Un petequiado axilar, retinal y subconjuntival con exudados hemorrágicos pueden visualizarse 48 hs después de comenzados los signos y síntomas anteriores.
Fisiopatológicamente se postulan dos teorías en la génesis de la embolia grasa: la teoría mecánica, con la entrada directa de las partículas de grasa a la circulación sanguínea, y la teoría bioquímica, donde se produce aglutinación de las partículas de grasa de origen endógeno o exógeno. Ambas teorías requieren que las partículas de grasa sean mayores de 8 micrones para embolizar. La teoría mecánica postula que las partículas de grasa ingresan a la circulación a partir de la presión que ocurre sobre la médula ósea, que fuerza a movilizar las partículas dentro de las vénulas y así embolizar. Este concepto postulado por Warthing y Gauss se mantiene desde hace mucho tiempo, a partir de investigaciones donde se determinó en tejido pulmonar la presencia de grasa marcada proveniente de la médula ósea de huesos con fracturas, pudiéndose prevenir la embolización con la aplicación de torniquetes sobre el miembro lesionado.
La teoría bioquímica promueve que los ácidos grasos tóxicos generan el aglutinamiento de los kilomicrones. Esta teoría, conocida como "the creaming phenomenon", afirma que en las emulsiones lipídicas los liposomas sufren una aglutinación que es calcio-dependiente debida a elevación de los niveles de la proteína C reactiva (PCR) unas 24 a 48 hs posteriores de ocurrido el daño tisular. Esto fue observado por Le Veen con los liposomas del Lipumol que aglutinaban y en cuya superficie se observaba una capa cremosa. Es así que se denominó el "creaming factor" a esta aglutinación calcio-dependiente influenciada por los aumentos de la PCR.2,7,8
La vasculatura de los distintos órganos afectados se caracteriza por contener gotas de grasa con acumulación de plaquetas y fibrina, ocasionando distalmente lesiones de tipo isquémicas o hemorrágicas.
Estos tipos de lesiones dan lugar a la primera fase del SEG caracterizada por un estado de obstrucción vascular; pasando posteriormente a una segunda fase que sería iniciada por la grasa intravascular. El rol de la activación del sistema de coagulación entraría en esta fase secundaria de injuria, ocurriendo una coagulación intravascular diseminada, asociada frecuentemente con una embolia grasa severa.1 Es así que en el laboratorio puede detectarse una disminución de los niveles de hemoglobina, plaquetas y calcio, con aumento de los productos de degradación del fibrinógeno, apareciendo prolongación de los tiempos de coagulación, elevación de la lipasa sérica, ácidos grasos, cortisol, glucagón y catecolaminas.
Por el daño pulmonar que ocurre se detecta un aumento del espacio muerto fisiológico con hipoxemias severas, como consecuencia de una desigualdad en la ventilación perfusión, cuya expresión radiológica son infiltrados alveolares difusos en ambos campos pulmonares. Los glóbulos de grasa se pueden aislar en sangre, orina y secreciones pulmonares. Histológicamente, en los preparados de tejido pulmonar se observan espacios vacíos con capilares distendidos con eritrocitos moldeados a su alrededor, con la presencia de partículas de médula ósea. Es más seguro el diagnóstico cuando se utilizan las tinciones de oil red O, o sudan negro. Los histiocitos cargados con lípidos pero sin lípidos extracelulares no deben interpretarse definitivamente como evidencia de embolia grasa.2,4 La identificación de pacientes con embolia grasa puede ser dificultosa de establecer en forma clínica, ya que algunos de los hallazgos de la tríada clásica del síndrome (falla respiratoria aguda, disfunción cerebral y petequias) pueden estar ausentes. Los test de laboratorio que incluyen la detección de glóbulos de grasa en orina, en sangre y las mediciones de la actividad de la lipasa sérica pueden ser útiles para determinar la presencia de la embolia, pero carecen de sensibilidad y especificidad. Las gotas de grasa identificadas en extendidos de sangre obtenidas de catéteres insertados en la arteria pulmonar, combinados con un deterioro en el intercambio gaseoso demostrado por alteraciones en la tensión alvéolo-arterial de oxígeno, pueden ser un método de screening temprano y con mayor sensibilidad que las muestras de sangre tomadas por vías periféricas.9 Recientemente se reportó el lavado broncoalveolar (BAL) como una técnica útil para diagnosticar pacientes que padecen de embolia grasa. La tinción de los macrófagos con oil red O (ORO) recuperados con 150 a 200 ml de lavado puede identificar las gotas de grasa intracelulares en un 63% de las células (rango de 31 a 82%) en pacientes con SEG definido; mientras que en pacientes con traumas, SDRA (Síndrome de distress respiratorio del adulto) o voluntarios pero sin evidencia del síndrome se recuperaron menos del 2% de los macrófagos.10,11
El tratamiento del SEG es de tipo profiláctico y de soporte. La medida profiláctica más efectiva está en reducir las fracturas lo antes posible después de la lesión; siempre que la condición clínica del paciente lo permita, aporta beneficios al disminuir la incidencia de complicaciones pulmonares, generando una menor estadía en la UCI y hospitalaria y reduciendo, por lo tanto, los gastos por pacientes.12,13
Con respecto a la utilización de corticoides, más precisamente de pulsos de metilprednisolona (seis dosis de 1,5 mg/kg o una dosis total de 30 a 90 mg/Kg), administrada en forma temprana podría prevenir el desarrollo del SEG, principalmente de la hipoxemia que en él se genera, aunque se requiere un mayor número de estudios prospectivos para valorar esta terapia. El mecanismo por el cual los corticoides protegerían al pulmón es controvertido, pero sería por inhibición de la agregación de neutrófilos a nivel pulmonar que impediría el daño endotelial. Los episodios de hipoxemia arterial se tratan con suplemento de O2 administrado con cánula nasal o máscara; mientras que los episodios con una hipoxemia severa ocasionados por un shunt importante requerirían ARM, con el objetivo de mantener saturaciones siempre mayores al 90%.
Conclusión
Se necesita un alto grado de sospecha para hacer el diagnóstico de embolia grasa, frecuentemente mortal.
Bibliografía
- Popovich J. Pulmonary embolism. In: Care Medicine. Principles of Diagnosis and Management. Joseph Parrillo y Roger Bone (eds.), Mosby-Year Book, Inc. 1995, 781-799.
- Hulman G. The pathogenesis of fat embolism. Journal of pathology. 1995, 176: 3-9.
- Fabian, T. Unraveling that embolism syndrome. N Engl J Med. 1993, 329: 961-963.
- Dines D; Linscheid R; Didier E. Fat embolism syndrome. Mayo Clin. Proc. 1972, 47: 237-240.
- Rommers P; Claes P. Massive fat embolism syndrome after unsuccessful unreadmed nailing of the tibia. Arch Orthop Trauma Surg. 1997, 116 (3): 184-186.
- Genter C; Braun Th. Fat embolism syndrome. Chaning prognosis. 1981, Chest 79: 143-145.
- Hulman G. Pathogenesis of non-Traumatic fat embolism. Lancet. 1988, 1: 1366-1367.
- Hulman G; Pearson HJ; Fraser I. Agglutynation of intralipid by sera of acutely ill patients. Lancet. 1982, 1426-1427.
- Tengs QS; Li G. Experimental study of early diagnosis and treatment of embolism syndrome. J Orthop Trauma. 1995, 9 (3): 183-189.
- Chastre J; Fagon JY; Soler P. Bronchalveolar lavage for rapid diagnostic of fat embolism syndrome in trauma patients. Ann Intern Med. 1990, 113: 583.
- García-Sature J; Prados C; García Rio F.The usefulness of bronchoalveolar lavage for the diagnosis of a fat embolism. Med Clin Barc. 1995, 104 (13): 518.
- Behrman S; Fabian T; Kudsk K. Improved outcome with femur fracture: early vs. delayed fixation. J Trauma. 1990, 30: 792-797.
- Fabian T; Hoots A; Stanford D. Fat embolism syndrome: prospective evaluation in 92 fracture patients. Crit Care Med. 1990, 18: 42-46.
- Kallenbach J; Lewis M; Zaltzman M. Low dose corticosteroid prophylaxis against fat embolism. J Trauma. 1987, 27: 1173-1176.
- Schonfeld S; Yongyudh P; DiLisio R. Fat embolism prophylaxis with corticosteroids. A prospective study in High-risk patients. Ann Intern Med. 1983, 99: 438-443.