Enzo Daniel Graziola: Médico Anestesiólogo del Hospital Italiano Garibaldi de Rosario. Doctorando de la Carrera de ôDoctorado en Ciencias Biomédicasö de la Facultad de Ciencias Médicas de la Universidad Nacional de Rosario.
Dirección Postal: Dr. Enzo Daniel Graziola- French
1322 (2000) Rosario. Santa Fe. Argentina.
E-mail: graziola@xlnet.com.ar
Introducción
Las citoquinas son glucoproteínas o proteínas de bajo peso molecular producidas durante la fase de iniciación o en la fase efectora de la respuesta inmune con el objeto de mediar y regular la amplitud y duración de las respuestas inmune/inflamatorias.
Son producidas por la activación de leucocitos y también por la activación de células neurales, fibroblastos y células endoteliales. La activación de estas células es uno de los hechos más precoces de la respuesta celular a la agresión tisular. El otro estímulo muy importante frente a la agresión tisular son los impulsos aferentes neuronales del tejido dañado o sitio de la cirugía.
La respuesta inmune es consecuencia de la interacción entre los linfocitos T (LT), los linfocitos B (LB) y los monocitos/macrófagos. Todas estas células deben comunicarse entre sí y de ello se encargan las citoquinas. Además, las citoquinas son el principal mensajero del sistema inmune al cerebro, de modo tal que éste recibe información del sistema inmune y responde a ella.
Para poder comprender la importancia del estudio de las citoquinas por los profesionales médicos relacionados con la anestesia, cirugía, trauma y medicina crítica, se las debe ubicar en el contexto de las respuestas elaboradas por el organismo ante la agresión quirúrgica, traumática y/o infecciosa.
La cirugía provoca una amplia variedad de cambios metabólicos que incluyen hiperglucemia, pérdida de masa muscular, síntesis de proteínas de fase aguda y aumento de leucocitos en la sangre periférica. Dichos cambios se originan en las aferencias neuronales, somáticas y autonómicas, y en la liberación de citoquinas desde el sitio de la lesión tisular.
Aunque las técnicas anestésicas bloqueen completamente las aferencias neuronales, como puede conseguirse en la cirugía de miembros inferiores, órganos de la pelvis u ojo, las respuestas neuroendocrinas e inmunológicas pueden retrasarse, pero no desaparecen completamente.
La respuesta al estrés quirúrgico se inicia por tres factores fundamentales:
- percepción psicológica (corteza límbica), relacionada con la ansiedad preoperatoria
- pérdida de líquido extracelular (receptores de volumen)
- daño tisular (estimulación de las vías nociceptivas y liberación de citoquinas)
En esta revisión se tratará la activación de la red de citoquinas y la respuesta de fase aguda producida en la cirugía y el trauma. La secreción crónica de citoquinas, por ejemplo en la sepsis, deberá ser motivo de otra revisión.
Características de las citoquinas
Las citoquinas no se encuentran preelaboradas en compartimentos celulares sino que su síntesis se inicia luego de interacciones precisas e involucra la transcripción y síntesis de ARN mensajero (ARNm).
Una misma citoquina puede ser producida por múltiples tipos celulares, y a su vez cada una de ellas puede actuar sobre células diferentes (pleiotropismo).
Las citoquinas interactúan entre sí:
- pueden inducirse las unas a las otras
- pueden modular el receptor de otra
- pueden tener efectos sinérgicos, aditivos o antagonistas
Existe, pues, una considerable superposición y redundancia de efectos entre las mismas.
Las citoquinas pueden ejercer su acción:
- en el nivel local (acción autocrina), activando receptores presentes en las mismas células elaboradoras
- en el nivel de receptores de células que se encuentran en la cercanía (efecto paracrino)
- sobre células distantes (efecto endocrino), en el caso de que las concentraciones liberadas hacia el torrente circulatorio sean muy altas.
La respuesta celular a las citoquinas también es lenta (horas), pues requiere de la formación de ARNm y la posterior síntesis de proteínas.
La acción de las citoquinas se produce por unión a receptores específicos y de muy alta afinidad, razón por la que son requeridas muy pequeñas cantidades para gatillar el efecto biológico.
Los receptores se encuentran en la superficie celular y su expresión es regulada a través de señales específicas que pueden ser generadas por otra o aún la misma citoquina, lo que permite amplificar la señal positiva o generar un efecto de retroalimentación negativa.
La función de los receptores es la de reconocer especí-ficamente a una citoquina y convertir esa interacción en una señal intracelular adecuada.
Todos los receptores son glucoproteínas constituidas por tres regiones:
- un dominio extracelular, el cual provee la región de reconocimiento para la citoquina y determina la especificidad
- una región transmembrana expandida a lo largo de la bicapa lipídica de la membrana plasmática
- dominio intracelular responsable de generar la señal de transducción
Asimismo existen receptores solubles que surgen del clivaje proteolítico de receptores de membrana o por empalmes alternativos de los ARNm, cuya principal función sería regular los efectos biológicos de las citoquinas.
Importancia de las citoquinas en la anestesia y la cirugía
La inmunodepresión observada luego de una cirugía mayor es el resultado, principalmente, de la disfunción de los linfocitos T, y se caracteriza por un deterioro de la síntesis de IL-2 e interferón gamma (INF-
g). La incapacidad de producir una adecuada cantidad de IL-2 causa una incompleta proliferación de linfocitos T helper en respuesta a la estimulación antigénica, y una deficiencia en el INF-g resulta en un deterioro de la capacidad de presentación antigénica de los monocitos.
Las citoquinas producidas en respuesta a la cirugía están involucradas en:
- respuesta inflamatoria no específica
- respuesta inflamatoria específica
- hematopoyesis
- reparación de tejidos
Respuesta de fase aguda
Es una respuesta a la destrucción tisular que:
- limita el daño tisular
- aísla y destruye organismos infecciosos
- activa los procesos de reparación necesarios para el retorno del órgano dañado a su función normal.
En los procesos agudos, como en una cirugía sin complicaciones, dura unos pocos días.
La respuesta de fase aguda consiste en:
- alteración de la temperatura por acción directa sobre el hipotálamo de algunas citoquinas, generando una respuesta febril mediada a través de la producción de postaglandina E2 (PGE2)
- cambios en la composición de las proteínas plasmáticas (proteína C reactiva, glucoproteína ácida 1, a 1 antitripsina, a 2 macroglobulina y proteína amiloide sérica)
- aumento en el número de granulocitos en la sangre periférica, inicialmente como un aumento de la liberación los depósitos de la médula ósea y posteriormente por aumento en su producción
- la IL-1 y la IL-6 estimulan la secreción de ACTH y por consiguiente la producción de cortisol. Esos aumentos ejercen un efecto de retroalimentación sobre las citoquinas, ya que inhiben la expresión de los genes productores de citoquinas.
Las proteínas de la fase aguda (más de 30) son sintetizadas en el hígado y están involucradas en el proceso inflamatorio y de reparación de tejidos. Algunas son útiles como indicadoras de la presencia y magnitud del proceso inflamatorio, como la proteína C reactiva.
Los macrófagos o monocitos son los que comienzan la respuesta de fase aguda en el sitio del daño tisular liberando un amplio espectro de mediadores, de los cuales la IL-1 y el TNF-a son iniciadores del proceso, actúan localmente sobre las células del estroma fibroblastos y células endo-teliales y también a distancia, resultando en una segunda fase de liberación de citoquinas. En esta fase, la IL-6 es la más importante y su efecto primario es la inducción hepática de la producción de proteínas de la fase aguda.
Las citoquinas más estudiadas en relación con la cirugía son: IL-1, IL-2, IL-6, TNF-a e INF-g.
Interleuquina 6 (IL-6)
Es producida principalmente por los macrófagos, pero también es segregada por las células del endotelio vascular, fibroblastos y por algunos LT activados, en respuesta a la estimulación de IL-1 y en menor grado por TNF-a. También es estimulada su secreción por la acción adrenérgica.
Comparte acciones biológicas con la IL-1 pero, a diferencia de ella, no causa trombosis intravascular ni injuria tisular. Se destaca la acción sobre los hepatocitos, a los que estimula para producir proteínas de fase aguda.
La IL-6 ha sido una de las más estudiadas con relación al estrés anestésico-quirúrgico. Sus valores en sangre aumentan después de todo tipo de cirugía mayor, pudiéndose detectar incrementos a los 30 minutos de la incisión de la piel, y alcanza los valores pico entre las 2 a 4 horas después de la cirugía. Se ha demostrado que existe una buena correlación entre el incremento en los valores de IL-6 y la magnitud de la lesión tisular por la cirugía1.
También es importante el efecto de las drogas anestésicas sobre los niveles de IL-6. Los opiáceos disminuyen transitoriamente la liberación de citoquinas durante la cirugía2. Croiser y col. registraron un descenso significativo en los valores plasmáticos de IL-6 en un grupo de pacientes que recibieron anestesia endovenosa con propofol y alfentanil, respecto del grupo inhalatorio que recibió isoflurano y fentanil. La más probable explicación para la atenuación de la respuesta de la IL-6 en pacientes que recibieron anestesia IV es que las drogas usadas modularon directamente su liberación.
El alfentanil parece ser el principal responsable, aunque no puede descartarse la influencia que pueda tener el propofol. Las razones a favor del alfentanil son que los monocitos, que secretan IL-6, poseen en su membrana receptores para opioides que pueden inducirlos a reducir la concentración de cAMP, habiéndose demostrado que la secreción de IL-6 es disparada por un aumento intracelular de cAMP. Por lo tanto, al impedir el aumento de cAMP podría atenuarse la expresión de IL-6.
Moore M y col.3 estudiaron la influencia del bloqueo peridural sobre los niveles sanguíneos de IL-6. En el grupo control (anestesia general solamente) observaron un aumento de la IL-6 a las 4 horas de comenzada la cirugía, que se mantuvo elevada hasta 48 horas del postoperatorio. En contraste, en el grupo que además de anestesia general tuvo un bloqueo peridural hasta el nivel T4, la IL-6 comenzó a elevarse a valores similares a los del grupo control recién a las 12 horas del comienzo de la cirugía. Es decir, la analgesia peridural retrasó pero no impidió la producción de IL-6. Sin embargo, la analgesia peridural no afectó los valores de proteínas de la fase aguda producidas por los hepatocitos por estímulo de la IL-6.
En el mismo trabajo comprobaron que el cortisol en el grupo control comenzó a aumentar a la hora de comenzada la cirugía, alcanzó el pico máximo a las 4 horas y comenzó a declinar progresivamente hasta alcanzar valores similares al basal a las 48 horas. En el grupo que recibió bloqueo peridural, el cortisol no aumentó hasta una hora después de iniciada la cirugía, comenzó a elevarse luego y alcanzó el pico a las 4 horas, pero con valores muy inferiores a los del grupo control. Los autores consideran que dada esa falta de relación temporal entre la producción de IL-6 y de cortisol, es improbable que la IL-6 contribuya en forma importante a los cambios de secreción de la hipófisis.
Los niveles elevados de IL-6 son considerados de valor pronóstico en pacientes con trauma, infección, hemorragia, etc. En un trabajo de Baigrie RJ y col.4, la IL-6 de tres pacientes que tuvieron complicaciones se elevó muy por encima de los valores medios dentro de las pocas horas de la incisión, mientras que en ningún caso hubo sospecha de pobres progresos hasta las 24-48 hs después. Los aumentos de IL-6 en el grupo que presentó complicaciones no solo precedieron 12 horas a los signos clínicos, sino que se mantuvieron por más tiempo que en el grupo con menores complicaciones.
Se ha descrito el efecto depresor miocárdico de la IL-6. La reperfusión del miocardio, luego del paro cardíaco durante la cirugía de corazón a cielo abierto, está asociada con infiltración de leucocitos y macrófagos, que podrían ser los responsables de la transitoria depresión miocárdica. La producción de citoquinas por los macrófagos pulmonares en respuesta al daño tisular durante el by pass aorto-coronario determinaría que su concentración sería elevada en la sangre de las venas pulmonares. Por eso se midió la concentración de TNF-a e IL-6 en 7 pacientes antes y después de un by pass aorto-coronario no complicado5. Los niveles sanguíneos de ambas citoquinas fueron indetectables antes de la cirugía, pero aumentaron dramáticamente en todos los pacientes luego del by pass. En el mismo estudio se sometió in vitro a músculos papilares de hámsters y humanos a concentraciones crecientes de IL-6 en el baño del preparado, observándose un efecto inotrópico negativo directamente relacionado con la concentración, que comienza a los 2 a 3 minutos de agregar la IL-6, alcanza el máximo a los 5 minutos, permanece constante durante 20 minutos y revierte completamente a los 40 minutos de haber eliminado del baño la interleuquina. Estas evidencias apoyan la idea de que niveles clínicos de IL-6 deprimen el miocardio.
Recientemente se reportó un aumento en la producción de óxido nítrico por la citoquinas en miocitos aislados de ratas, el cual tiene un efecto inotrópico negativo. Probablemente éste sea el mecanismo por el cual la elevación de la IL-6 tiene un efecto depresor6.
A pesar de estas observaciones, no es posible aún determinar el valor pronóstico de los niveles de IL-6 o los beneficios del uso de anticuerpos contra la IL-6, que modularían la actividad de la interleuquina libre.
No deja de ser interesante preguntarse si los niveles de IL-6 que se producen durante el estrés quirúrgico de pacientes sépticos estarían involucrados en los efectos inotrópicos negativos que tan frecuentemente se observan durante estas intervenciones mediante la interacción con las drogas anestésicas.
Factor de necrosis tumoral (TNF-a)
Es sintetizado, principalmente, por los macrófagos activados, aunque también por las células NK, células endo-teliales y LTh1. Es la principal citoquina elaborada en respuesta contra infecciones bacterianas por agentes gram-negativos. A bajas concentraciones tiene efectos autocrinos y paracrinos aumentando la expresión de moléculas de adhesión, lo que facilita la adherencia de neutrófilos, monocitos y linfocitos a las células endoteliales y permite la acumulación de leucocitos en el sitio de la inflamación. Produce activación de los neutrófilos, eosinófilos y macrófagos. Estimula a los fagocitos mononucleares a producir IL-1, IL-6 y el propio TNF-a.
A altas concentraciones tiene efectos endocrinos, actúa sobre los centros hipotalámicos induciendo fiebre, al igual que la IL-1, y sobre la síntesis de postaglandinas en las células hipotalámicas. Estimula a los macrófagos y a las células endo-teliales induciendo niveles de IL-1 e IL-6 que alcanzan la circulación y estimulan a los hepatocitos a producir proteínas de la fase aguda y activa el sistema de coagulación. En condiciones extremas lleva al organismo a un estado de caquexia (por pérdida de apetito y de proteínas y grasa), pérdida de la contractilidad cardíaca, producción de postaciclinas por parte del endotelio vascular (con pérdida de tono del músculo cardíaco), trombosis vascular y shock.
Se intentó correlacionar los niveles aislados de citoquinas con el pronóstico ante determinadas patologías, como sepsis y quemaduras, siendo el TNF-a una de las citoquinas más estudiadas. Sin embargo, no ha sido demostrado que los niveles séricos de TNF-a afecten la resolución clínica de dichas patologías cuando se evalúan sus niveles en conjunción con la clínica y el laboratorio4. En duodenopancreatectomías bajo anestesia general suplementada con analgesia peridural hasta un nivel de T2 y T4, Yoshiyuki y col.7 detectaron un aumento de los niveles séricos de TNF-a que se correlaciona con el aumento de endotoxinas en sangre, mientras que en un grupo de pacientes sometidos a cirugía de cadera con similar anestesia suplementada con analgesia peridural hasta un nivel de T8 a T10, en donde no se elevó el nivel sérico de endotoxina, tampoco se elevó el nivel de TNF-a.
Interleuquina 1(IL-1)
La IL-1 es la citoquina más importante de los procesos inflamatorios, infecciosos, lesión tisular y enfermedades malignas, desencadenando una respuesta de fase aguda que se caracteriza por:
- fiebre
- aumento de la permeabilidad vascular
- síntesis de proteínas de fase aguda
Existen dos tipos de IL-1, cada una de ellas codificada por un gen independiente, aunque son capaces de reconocer el mismo receptor.
De la todas las células que secretan la IL-1 el macrófago es el mayor productor. En humanos, los macrófagos secretan preponderantemente la IL-1▀, mientras otros tipos de células producen principalmente IL-1a: células endo-teliales, astrocitos, células gliales, células NK, células del epitelio de la córnea, células de Kupffer, células dendríticas, células mesangliales renales y células ciliares neuronales.
La IL-1 activa el eje hipotalámo-hipofisario causando la liberación de glucocorticoides. Los macrófagos responden a la IL-1 liberando postaglandinas E2 (PGE2) y produciendo TNF-a. La PGE2 puede inhibir la producción de IL-1 por parte del macrófago, generando un proceso autolimitante. La IL-1 induce la síntesis de PGE2 en las células endoteliales y las células del músculo liso. Además, induce su propia síntesis y la producción de TNF-a e IL-6.
La precoz y breve respuesta de la IL-1▀ a la cirugía siempre precede a la respuesta de la IL-6, lo que reafirma el concepto de que la IL-1▀ induce la síntesis de IL-6. Sin embargo, los valores de IL-1 son tan bajos que no son detectados en una única muestra de sangre y sólo pueden obtenerse resultados positivos por muestreos frecuentes.
Interferón g (INF g)
El INF-g es producido cuando ya se está montando una respuesta inmunitaria específica, adaptativa, por los LTh1 (CD4+), por los LT CD8+ y en menor grado por las células NK. Tiene efectos reguladores de la respuesta inmune, promoviendo fundamentalmente la inmunidad antiviral y antiprotozoarios. Estimula la capacidad microbicida de los macrófagos y neutrófilos, ya que estimula el estallido respiratorio, favorece el reconocimiento antigénico, promueve la diferenciación de los linfocitos T vírgenes hacia clones Th1, con alta producción de INF-g, e inhibe la proliferación de clones Th2. Además, es un potente activador de las células NK y actúa sobre las células endoteliales potenciando los efectos del TNF-a.
Rentenaar y col.8 estudiaron los efectos de la administración de recombinante humano de INF-g versus placebo sobre la inmunodepresión inducida por cirugía abdominal (duodenopancreatectomía). Demostraron que aumenta la densidad de receptores de antígeno de los linfocitos T (TCRs) y concomitantemente previene la depresión de la reactividad de las células T CD4+ a antígenos específicos. Los autores opinan que dado que muchos pacientes sometidos a esta cirugía presentan infecciones en el postoperatorio, la preservación de la función inmune de estos pacientes mediante la administración de INF-g puede ser beneficiosa. Sin embargo, los pacientes deben ser cuidadosamente seleccionados, ya que la investigación citada se realizó en individuos sin infección instalada.
Influencia de las citoquinas inflamatorias sobre la actividad secretoria del eje hipotálamo-hipófisis-suprarrenal (HPA)
Aunque la mayoría de las citoquinas estimulan el eje HPA, dos de ellas, IL-4 e INF-g, tienen efecto inhibidor.
Las citoquinas inflamatorias TNF-a, IL-1 e IL-6 estimulan, en etapa temprana, a las neuronas hipotalámicas a secretar factor de liberación de corticotrofina (CRF) y arginina-vasopresina (AVP), que inducen a la hipófisis a secretar ACTH y ésta a la corteza suprarrenal a secretar glucocorticoides (GC). Los mismos mediadores pueden estimular el sistema catecolaminérgico central (LC/NE) y los nervios simpáticos postganglionares (SPGN). Los GC inhiben directamente las células inmunes periféricas, mientras las CRF, AVP, ACTH y ▀-endorfinas juegan un rol inmunopotenciador o pro inflamatorio. Estos neuropéptidos son producidos por fibras aferentes sensoriales (SAM), nervios simpáticos postganglionares, células inmunes y células inmunes accesorias (Fig. 1).
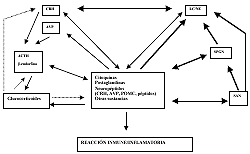 [ Ampliar imagen ] |
| Figura 1: Interacción entre cerebro, eje HPA, sistema simpático, sistema nervioso periférico y respuesta inmune/inflamatoria. Las citoquinas inflamatorias TFN- a , IL-1 e IL-6 estimulan en forma aguda al hipotálamo a secretar Factor liberador de corticotrofina (CRH) y arginina-vasopresina (AVP), la corticotrofina pituitaria a secretar ACTH y la corteza suprarrenal produce glucocorticoides (GC). Los mismos mediadores pueden estimular al sistema central catecolaminérgico (LC/NE) y a los nervios postganglionares simpático (SPGN). Los GC directamente inhiben el sistema inmune periférico, mientras que la CRH , AVP, ACTH y las ß-endorfinas juegan un rol inmunopotenciador o pro-inflamatorio. Estos neuropéptidos son producidos localmente por fibras sensoriales eferentes (SAN), nervios postganglionales simpáticos y células inmunes o accesorias, actuando como autacoides. |
Entre todas las citoquinas, tres (TNF-a, IL-1 e IL-6) son las responsables de la mayor estimulación del eje HPA asociado con la respuesta inflamatoria/inmune. La TNF-a es la primera en aparecer en la cascada inflamatoria de eventos y estimula la secreción de IL-1 e IL-6. Igualmente, la IL-1 estimula la secreción de TNF-a e IL-6. En contraste, la IL-6 inhibe a ambas citoquinas. Todas estimulan su propia producción por vía autocrina y paracrina (Fig. 2).
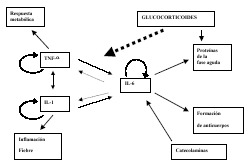 [ Ampliar imagen ] |
| Figura 2: Interacción entre las citoquinas inflamatorias y sus efectos estimulantes sobre las neuronas CRH y AVP durante la respuesta inmune/inflamatoria. El endotelio del capilar del cerebro y las células gliales pueden participar en una cascada local que conduce a la activación de las neuronas del hipotálamo. Líneas punteadas: indican inhibición. Líneas llenas: indican estimulación |
El endotelio capilar del cerebro y las células gliales pueden participar en la cascada local activando las neuronas del hipotálamo.
Las microglías, que embriológica y funcionalmente se relacionan con los macrófagos y astrocitos, son, al igual que los macrófagos y los monocitos, activados por toxinas, antígenos y productos de células dañadas dentro del cerebro o por sustancias que alcanzan el cerebro desde la periferia. Al activarse, estas microglías pueden secretar citoquinas y mediadores inflamatorios. Las células endo-teliales y las células musculares lisas de los vasos sanguíneos en el cerebro pueden también secretar citoquinas tales como IL-1 e IL-6, en respuesta a antígenos y toxinas circulantes.
En pacientes con cáncer tratados con IL-6 se comprobó que la administración de 3 mg/kg por vía subcutánea produce un pico de ACTH en plasma a los 60 a 90 minutos y de cortisol en plasma a los 90 a 120 minutos, con relativamente pocos efectos tóxicos (a diferencia de las otras citoquinas), por lo que algunos autores proponen que se la utilice para evaluar la función del eje HPA.
Las citoquinas actúan sobre diversas estructuras del cerebro donde se han encontrado receptores, tanto in vivo como en líneas celulares cultivadas9. También son sintetizadas dentro del cerebro, aunque en la mayoría de los casos, sujetos sanos o sin estrés, la expresión es baja. La IL-1▀ se encontró en neuronas del hipotálamo, incluyendo la región peri-ventricular el pPVN y la eminencia media. Esta distribución es congruente con el rol de la IL-1▀ como neuroregulador de las respuestas de la fase aguda y en particular del eje HPA.
La expresión de numerosas citoquinas dentro del SNC aumenta marcadamente durante el daño celular. Las concentraciones de IL-1▀, IL-6 y TNF-a están elevadas durante la infección bacteriana y viral del SNC, el trauma cerebral, la isquemia cerebral y las convulsiones. Además, su expresión se eleva durante numerosos procesos crónicos del SNC como esclerosis múltiple, síndrome de Down y enfermedad de Alzheimer.
La inducción de la síntesis de citoquinas dentro del cerebro parece ser mayor en las microglías, aunque las células vasculares, astrocitos y neuronas contribuyen con su producción.
Los experimentos realizados con lipopolisacáridos (LPS), en una dosis que no altera la barrera hematoencefálica (BBB), permiten inferir que el efecto se debe a la acción directa del estímulo y no a la acción de las células de sangre periférica que atraviesen la BBB9. Muchos estudios realizados con anterioridad utilizando dosis grandes de LPS no pudieron aclarar el origen de las células que reaccionaban al estímulo, ya que grandes dosis de LPS alteran el funcionamiento de la BBB.
La principal evidencia de que el SNC es el órgano primario de acción de las citoquinas sobre el eje HPA, en vivo, se deriva de experimentos en ratas donde el CRF es inmuno-neutralizado, tras lo cual se inhibe la elevación de las concentraciones plasmáticas de corticotrofina luego de la administración de IL-1a, IL-1▀, IL-6 y TNF-a.
Se han propuesto varios mecanismos para explicar la actividad de la IL-1 sobre las estructuras cerebrales, que aún están siendo investigados:
- penetración en el cerebro a través de la BBB
- estimulación de intermediarios difusibles
- producción de intermediarios en la BBB
- pasaje a través de estructuras desprovistas de BBB
- a través de la activación de un grupo de células medulares catecolaminérgicas
- activación de nervios periféricos (vagal), inducción de mRNA de varias citoquinas en diversas regiones del cerebro (corteza, cerebelo, tálamo, hipocampo e hipotálamo) con picos de aumento a las 2 a 4 horas.
Como se ha expuesto, las citoquinas juegan un rol fundamental en el control de la función inmunológica normal y en los mecanismos de defensa y crecimiento celular normal. Considerando que el estrés anestésico-quirúrgico y el trauma pueden afectar dichos procesos, es importante investigar si modificando la producción y función de las citoquinas se puede disminuir la tasa de morbilidad y mortalidad después de la cirugía o enfermedades críticas.
Bibliografía
- Chuickshank AM; Fraser WD; Burns HJG et.al. Response of serum interleukin-6 in patients indergoing elective surgery of varying severity. Clinic Science 1990;79:161-165.
- Crozier TA; MŘller JE; Quittkat D et al. Effects of anaesthesia on the cytokine responses to abdominal surgery. Br J Anaesth 1994;72:280-285.
- Moore M; Desborough JP; Powell H et.al. Effects of extradural anaesthesia on interleukin-6 and acute phase response to surgery. Br J Anaesth 1994;72:272-279.
- Baigrie RJ; Lamont PM; Kwiatkowski D et.al. Systemic cytokine response after major surgery. Br J Surg 1992;79:757-760.
- Finkell MS; Hoffman RA; Shen L et.al. IL-6 as a mediator of stunned myocardium. The American Journal of Cardiology 1993;71:1231-1232.
- Schulz R; Nava E; Moncada A. Induction and potential biological relevance of calcio-independent nitric oxide sybthase in the myocardium. Br J Pharmacol 1992;105:575-580.
- Yoshiyuki N; Sunao T; Koh S et.al. Responses of plasma adrenocorticotropic hormone, cortisol and cytokine during and after abdominal surgery. Anesthesiology 1992;77(3):426-431.
- Rentenaar JRJ; De Metz J; Bunders M et al. Interferon-gamma administration after abdominalsurgery rescues antigen-specific helper T cell immune reactivity. Clin Exp Immunol 2001; 125: 401-408.
- Turnbull AV; Rivier CL. Regulation of the hypothalamic-pituitary-adrenal axis by cytokines: actions and mechanisms of action. The American Physiological Society 1999;79(1):1-85.