Dirección postal: (1414) Aráoz 1547 6º A Ciudad Autónoma de Buenos Aires
E-mail: luismoggi@sion.com
Introducción
Se define como hipertensión arterial (HTA) a la elevación persistente de la presión arterial a valores superiores a los percentiles considerados como normales en relación a la edad, el peso y la talla de las personas1,2.
Para las niñas, por ejemplo, corresponden los gráficos 1 y 2.
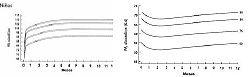 [ Ampliar imagen ] |
| Presión arterial sistólica y diastólica en niñas de hasta 12 meses. Reproducido de Nefrología Pediátrica. Sociedad Argentina de Pediatría. Comité Nacional de nefrología Pediátrica, 2003. |
Existe un acuerdo internacional para catalogar la HTA según la distribución de los valores de la presión arterial (PA) en percentiles (p). Así, se define como:
PA normal : valores bajo el p90.
PA normal-alta : valores entre el p90 al 94
HTA significativa: valores entre el p95 y el 99, en más de tres ocasiones
Hipertensión severa: valores sobre el p99, en más de tres ocasiones.
PA normal: valores inferiores al p90.
PA normal-alta: valores entre p90 y 94.
HTA significativa: valores entre p95 y p99 en más de tres ocasiones.
Hipertensión severa: valores superiores al p99 en más de tres ocasiones.
Con fines prácticos se deben considerar patológicas las siguientes cifras de PA en recién nacidos (Tabla I).
| TABLA I Cifras de presión arterial patológicas en recién nacidos |
|||
| Peso al nacer (gr.) | TAM (mmHg) | TS | TD |
| 505 750 | 38 49 | 50 62 | 26 36 |
| 751 - 1000 | 35,5 47,5 | 48 59 | 23 36 |
| 1001 1250 | 37,5 48 | 49 61 | 26 35 |
| 1251 1500 | 34,5 44,5 | 46 56 | 23 33 |
| 1501 1750 | 34,5 45,5 | 46 58 | 23 33 |
| 1751 2000 | 36 48 | 48 61 | 24 35 |
En niños de mayor edad:
| Lactantes | > 110/70 mm Hg |
| Pre-escolar, entre 2 y 5 años | > 115/75 mm Hg |
| Escolares hasta los 10 años | > 120/80 mm Hg |
| Adolecentes hasta los 15 años | > 130/85 mm Hg |
En los recién nacidos (RN) la incidencia de HTA es del 0,2%, pudiendo ser del 2,5% en los pacientes con mayor riesgo, 3-8% en aquellos con cateterización umbilical, y 6-43% en los RN de término con displasia broncopulmonar y que pueden tener manifestaciones cardíacas (disfunción ventricular izquierda, insuficiencia cardíaca y shock cardiogénico) y neurológicas (temblores, convulsiones, hipertonía, riesgo de hemorragia intraventricular, etc.3).
Como regla, en los neonatos se considera HTA a los valores superiores a 90 mmHg de tensión sistólica y 60 mmHg de tensión diastólica; y en los prematuros mayores, a valores por encima de 80 mmHg de tensión sistólica y 50 mmHg de tensión diastólica. Se interpreta hipertensión arterial grave cuando los valores son superiores a los 100 mmHg de tensión arterial sistólica durante la primera semana de vida o mayores a 110 mmHg de tensión arterial sistólica durante la segunda semana4.
La frecuencia de HTA en pediatría es de 1-3% en niños y adolescentes; en la mayoría de los casos se trata de hipertensión arterial moderada, clasificada como primaria o esencial. La prevalencia de la HTA secundaria y de intensidad mayor es del 0,1% aproximadamente.
Para especificar:
- Presión arterial normal: valores de presión sistólica y diastólica por debajo del percentil 90, para edad y sexo.
- Presión arterial normal alta: valores situados entre los percentiles 90 y 95.
- Hipertensión arterial establecida o significativa: valores por encima del percentil 95.
- Hipertensión arterial grave: con lectura de 10-20 mmHg por arriba del percentil 99.
| TABLA II Clasificación de la hipertensión arterial en el niño según la edad: | |||
| Edad | Presión arterial normal-alta (mm Hg) |
Hipertensión significativa (mm Hg) | Severa (mmHg) |
| 7 días | 96-105 PAS | > 106 PAS | |
| 8 - 30 días | 104 - 111 PAS | 104-109 PAS | >110 PAS |
| < 2 años | 104-111/70-73 | 112-117/74-81 | > 118 /82 |
| 3-5 años | 108-115/70-75 | 116-123/76-83 | > 124/84 |
| 6-9 | 114-121/74-77 | 122-129/78-85 | >130-86 |
| 10 -12 | 122-125/78-81 | 126-133/82-89 | > 134-90 |
| 13- 15 | 130-135/80-85 | 136-143/86-91 | > 144/92 |
| 16 -18 | 136-139/84-89 | 140-149/90-97 | > 150/98 |
Los métodos para obtener los valores de la presión arterial pueden ser invasivos: cateterismo de la arteria umbilical en RN y de las arterias radial, cubital, pedia, tibial posterior o humeral en niños más grandes, técnica indicada cuando se requiere monitoreo continuo y no exenta de riesgos. Las técnicas no invasivas son el Doppler y la auscultatoria (enrojecimiento o flush en RN), en las cuales el tamaño del manguito debe ser aproximadamente :
| Edad | Ancho | Largo |
| 0 a 6 meses | 2,5 a 4,0 cm | 5,0 a 9,0 cm |
| 6 meses a 5 años | 7,5 a 9,0 cm | 17,0 a 19,0 cm |
| 5 a 15 años | 12,0 a 14,0 cm | 22,0 a 26,0 cm |
Etiología
En los primeros años de vida cerca del 90% de la HTA es de origen renal o renovascular, siendo las nefropatías el 78% de las causas de hipertensión arterial sostenida en los niños de 1 a 5 años, el 44% en los de 6 a 10 años y el 32% en los niños de 10 a 15 años.
Por lo tanto, las causas de origen renal son las más importantes durante los primeros años de vida, ya sean parenquimatosas (glomerulopatías primarias y secundarias, poliquistosis, riñón multiquístico, pielonefritis, tumor de Wilms, traumatismos, enfermedades metabólicas) o anomalías en las vías urinarias, (hidronefrosis, reflujo vésico-ureteral)5.
Las causas de HTA extrarrenales son:
- Endocrinas: relacionadas con el aumento de la producción y secreción de catecolaminas inducida por mineralo-corticoides o glucocorticoides o por otras alteraciones hormonales (hiperplasia suprarrenal congénita, hiper-aldosteronismo, Síndrome de Cushing, hipertiroidismo, hipotiroidismo, hiperparatiroidismo, tumores-adenomas solitarios benignos productores de aldosterona, neuroblastoma, feocromocitoma, etc.).
- Vasculares: trombosis vasculares, coartación de aorta, hipoplasia de aorta, estenosis arteria renal, arteritis inespecífica enfermedad de Takayasu, etc.
- Neurológicas: hipertensión endocraneal, neurofibroma-tosis, tumores de la cresta neural, encefalitis, menin-goencefalitis, traumatismo encéfalo-craneano, posquirúr-gicos, etc.
- Farmacológicas: corticoides anabólicos, agentes simpa-ticomiméticos, vitamina D, ciclosporina, pancuronio en algunos RN.
- Otras causas (menos frecuentes): displasia bronco-pulmonar, hipertensión crónica post-quemadura, sobrecarga hidroelectrolítica, oxigenación con membrana extracorpórea (ECMO), dolor posquirúrgico, etc.1-3.
Se llega al diagnóstico de hipertensión arterial esencial (HTAE) por descarte de las causas orgánicas de hipertensión secundaria de origen multifactorial, por combinación de factores genéticos (60%) y ambientales (40%).
| TABLA III Tamaño del manguito según edad | ||
| Edad | Ancho | Largo |
| 0 a 6 meses | 2,5 a 4,0 cm | 5,0 a 9,0 cm |
| 6 meses a 5 años | 7,5 a 9,0 cm | 17,0 a 19,0 cm |
| 5 a 15 años | 12,0 a 14,0 cm | 22,0 a 26,0 cm |
Existen factores genéticos que determinan un estado pre-hipertensivo:
- Los genes que influyen en el transporte de iones, que producen una alteración en el transporte del sodio en los glóbulos rojos, y del sodio y del calcio a nivel celular muscular arteriolar.
- La respuesta de las catecolaminas al estrés.
- Los ambientales como la obesidad, que ocasionan una resistencia selectiva a la insulina, con retención de sal y aumento de la actividad simpática.
Al riñón se lo ha vinculado a la génesis de la HTA a través de procesos regulatorios de la homeostasis del sodio debido a la compleja regulación del sistema renina-angiotensina-aldosterona (SRAA), ya sea por defecto epitelial tubular, por disbalance túbulo-glomerular o por fallas en la modulación de la respuesta aferente por excesiva sensibilidad a la angiotensina II; el SRAA se contrae aun en situaciones de expansión salina y disminución congénita en el número de nefrones con la consiguiente disminución de la superficie filtrante1. También por disbalance entre los factores relajantes y contráctiles locales derivados del endotelio (endotelinas que incrementan el calcio intracelular convirtiéndose en un potente factor de regulación constrictora y el factor de relajación endotelial, óxido nítrico), lo que activaría además la producción de epinefrina, serotonina y angiotensina II, originando de esta manera sustancias de agregación plaquetaria. Por otro lado, la acción de las hormonas calciotrópicas, cuya regulación puede estar alterada en la HTAE (parathormona, 1,25-dihidroxi-vit. D, calcitonina) y los niveles de prostaciclina (PGI2), kalicreínas, péptido natriurético y factores neurogénicos.
No se conoce el valor predictivo de la HTA esencial en niños y adolescentes ni si su tratamiento precoz podría modificar la morbilidad de la HTA del adulto.
Hipertensión arterial secundaria más frecuente en pediatría
Hipertensión renovascular
Ocurre en los menores de 3 años y es la principal causa de HTA en la segunda infancia y en la adolescencia. Las glomerulopatías son el origen más frecuente de esta HTA.
Cursa con el aumento de la presión arterial sistémica por hipoperfusión renal.
La lesión vascular puede ser unilateral o bilateral (40% aproximadamente en algunos síndromes como la neuro-fibromatosis). La estenosis renal resulta de lesiones fibro-displásicas (74%), aortitis abdominal (9%) y como complicación del trasplante renal (5%)6.
Cuando la luz vascular disminuye por debajo del 30% origina una mayor producción de renina, con la consiguiente activación del angiotensinógeno en angiotensina II, lo cual produce:
- Acción vasoconstrictora directa sobre el músculo liso de la pared arterial con aumento de la concentración de calcio y de la resistencia vascular periférica.
- Vasoconstricción de la arteriola eferente con aumento de la presión intraglomerular y de la fracción de filtración.
- Incremento de la degradación de la bradiquinina.
- Probable estimulación de la producción de endotelina e inhibición del factor de relajación endotelio-derivado (EDRF).
- Estimulación de la producción de aldosterona, con la consiguiente reabsorción del sodio y pérdida del potasio. Estos efectos son incrementados por la acción directa de la angiotensina II sobre el túbulo renal.
La persistencia de HTA origina lesiones de nefroangioes-clerosis (lesiones vasculares fibrodisplásicas de la capa vascular media generalmente en forma segmentaria) con disminución del filtrado glomerular y aparición de lesiones irreversibles, aunque se corrija el defecto de perfusión7,8.
La angioplastía percutánea trasluminal es una de las posibilidades terapéuticas.
Causas endocrinológicas
Feocromocitoma
Los tumores de origen neuroectodérmico dependen de la diferenciación de los neuroblastos simpáticos (feocromo-citoma-paraganglioma, neuroblastoma, ganglioneuroblas-toma y ganglioneuroma) y producen un exceso de catecola-minas.
El feocromocitoma es un tumor originado en las células cromafines (posee afinidad por las sales de cromo) que produce noradrenalina y adrenalina, provocando una HTA sostenida o intermitente con paroxismos hipertensivos sobreagregados cuando liberan periódicamente sus depósitos de catecolaminas (tumores menos activos, generalmente más grandes), siendo lo más frecuente la secreción de ambas catecolaminas en distintas proporciones.
En pediatría representa menos del 5% de los casos; pueden aparecer en cualquier tejido cromafín (médula adrenal, aurícula derecha, bazo, órganos de Zuckerkandl en la bifurcación aórtica, etc.). Se afirma que en adultos sigue la regla del 10 (el 10% son bilaterales, el 10% son familiares y el 10% son malignos)9.
Como enfermedad familiar, es parte de la neoplasia endocrina múltiple tipo II (NEM II) o del síndrome de von Hippel-Lindau. Este síndrome es una enfermedad autosómica dominante caracterizada por múltiples hemangioblastomas en retina, SNC y otros órganos, pudiendo formar neoplasias en distintos tejidos (riñón, pulmón, hígado) con un alto grado de penetrancia; la frecuencia de tumores bilaterales puede llegar al 50%10.
La neoplasia endocrina múltiple tipo II (NEM II) se clasifica en:
Tipo II a:
- Carcinoma medular de tiroides.
- Hiperplasia o adenoma paratiroideo.
- Feocromocitoma.
Tipo II b:
- Carcinoma medular de tiroides.
- Neuromas mucosos.
- Aspecto físico parecido al Síndrome de Marfán.
- Feocromocitoma.
La sintomatología es variada; los síntomas se relacionan con el aumento continuo de las catecolaminas, hipertensión arterial sostenida y paroxística, hipotensión arterial ortostática, arritmias cardíacas, sudoración excesiva, rubicundez facial, cefaleas y policitemia en ocasiones, pérdida de peso, intolerancia a la glucosa, alteraciones psicológicas, etc.
También se deben realizar dosajes de catecolaminas y sus metabolitos en plasma y orina:
Valores normales en plasma:
- Dopamina: <100 pg/ml
- Epinefrina: 40-100 pg/ml
- Norepinefrina: 170-330 pg/ml
En orina se debe dosar:
- Catecolaminas libres
- Metanefrina-normetanefrina
- ácido vanilmandélico (VMA)
- ácido homovaníllico (HVA)
Se ha prestado mucha atención a los cambios hemodi-námicos en el preoperatorio y durante la cirugía. Cuando hay una mayor secreción de norepinefrina predomina un efecto a, donde la HTA es diastólica y sistólica; cuando prevalece la secreción de adrenalina hay una mayor estimulación cardíaca (efecto a y b), con HTA predominantemente sistolica. La estimulación b 1 sostenida sobre el riñón produce un aumento de la producción de renina e incrementa la reabsorción tubular del sodio. La vasoconstricción constante hace que el volumen intravascular tenga una disminución relativa, lo que ocasiona valores altos del hematocrito11.
Sobre el metabolismo, la a estimulación inhibe la liberación de insulina por el páncreas y promueve la lipólisis y la glucogenólisis. Por el contrario, la b estimulación estimula la liberación insulínica del páncreas. En el tejido adiposo, la insulina produce la acumulación de glucosa y su conversión a ácidos grasos con esterificación con glicerol para formar triglicéridos.
En el preoperatorio, el exceso catecolamínico conduce a la glucogenólisis, a la lipólisis, con tendencia a la diabetes. Se cree que no se produce hipoglucemia con el tratamiento a bloqueante en el preoperatorio porque la glucogenólisis y la lipólisis son continuas; esto indicaría que, en el posto-peratorio, la hipoglucemia puede aparecer por b estimu-lación crónica, con la consiguiente liberación elevada de insulina12-14.
Las complicaciones en los pacientes tratados quirúrgica-mente de un feocromocitoma son generalmente consecuencia de un estímulo simpático a nivel cardiovascular. Las alteraciones metabólicas que se pueden producir como resultado de dicha estimulación son menos frecuentes pero de igual importancia.
Hiperplasia suprarrenal congénita
La forma más frecuente se debe al déficit de la 21-hidro-xilasa y no se asocia con HTA.
Las otras formas, déficit de la 11-hidroxilasa y déficit de la 17-hidroxilasa, son menos frecuentes y están asociadas a HTA por la presencia de hormonas mineralocorticoides15.
Anestesia e hipertensión arterial
Algunos de los mecanismos involucrados en la producción de la HTA son:
- Aumento de la actividad del sistema nervioso simpático.
- Aumento de los niveles del sistema renina-angiotensina-aldosterona.
- Retención de sal por incremento de los niveles de cortisol.
- Aumento de la reactividad vascular a catecolaminas.
- Inhibición de prostaglandinas vasodilatadoras.
- Hiperinsulinemia secundaria a una resistencia insulínica.
- Sobrehidratación.
Además, los corticoides son inductores de la enzima responsable de la conversión de norepinefrina en epinefrina (feniletanolamina N-metiltransferasa).
Al quirófano nos llega generalmente un paciente con HTA medicado, compensado y en la mayoría de los casos con buena analgesia. La utilización de bloqueos regionales para la desaferentación reversible y el uso de anestésicos inhalatorios halogenados son suficientes para el manejo intraoperatorio, además de un adecuado plan analgésico y la medicación antihipertensiva previa para el postoperatorio16.
Pero debemos estar preparados para la emergencia, la crisis hipertensiva que puede llevar a un compromiso funcional u orgánico de los órganos blancos.
Los órganos blancos o de choque (el cerebro, el corazón, el riñón y la visión) son los más susceptibles de lesionarse ante este cuadro agudo.
Por orden de frecuencia, un 30% de las crisis hipertensivas se observan en los pacientes con neuropatía por reflujo, un 30% en los pacientes con glomerulopatías, otro 30% en los pacientes con enfermedad renovascular y el 10% restante en los pacientes con insuficiencia renal crónica en plan de trasplante o post-trasplante renal, con síndrome urémico hemolítico (SUH), con coartación de aorta y en aquellos con feocromocitoma.
A nivel cerebral, el aumento intenso de la presión arterial puede inducir una isquemia si sobrepasa el límite de la autorregulación, con hiperemia, trasudación de fluidos por lesión de la barrera hemato-encefálica y edema cerebral vasogénico. Esta encefalopatía hipertensiva puede ocasionar un accidente cerebrovascular con hemorragia cerebral. Se debe realizar un diagnóstico diferencial en las infecciones (encefalitis, meningoencefalitis), tumor cerebral de crecimiento rápido, seudotumor cerebral, infarto y trombosis cerebral, encefalopatía por uremia, etc.17,18.
En los hipertensos de larga data la curva de autorre-gulación cerebral se traslada hacia la derecha.
En el corazón, la insuficiencia cardíaca congestiva (ICC) con edema pulmonar puede deberse a la HTA severa, mientras que el distrés respiratorio con ICC inexplicable puede ser una manifestación de la coartación de la aorta en los lactantes y los RN.
En el RN, la HTA da como síntomas: taquipnea, cardiome-galia, convulsiones, ICC, etc.19.
En el riñón, la alteración en la regulación de la circulación puede llegar a producir hematuria, proteinuria, poliuria e incluso insuficiencia renal, si la causa no se controla a tiempo. La regulación de la circulación renal también puede fallar por la existencia de un daño estructural vascular y una inadecuada secreción de renina en la nefrosis isquémica.
Tratamiento
El control de la presión arterial debe ser progresiva. Para lograr un adecuado flujo sanguíneo cerebral y de los otros órganos vitales, la presión no debe caer por debajo de los valores en los cuales los mecanismos de autorregulación son inefectivos para evitar la isquemia y la complicación de la hipotensión arterial (insuficiencia renal aguda, neuropatía isquémica del nervio óptico y mielopatía trasversa isquémica) lo que podría ser más dramático que el control de la hipertensión en sí20,21.
Se deben utilizar fármacos por vía endovenosa de rápido comienzo y corta duración de acción, realizando una evaluación continua de la presión arterial invasiva y de otros parámetros (oxicapnografía, PVC, electrocardioscopia, medio interno, proteínas totales, etc.).
Además de los fármacos específicos debemos utilizar otros para proteger al cerebro como la difenilhidantoína, el fenobarbital, etc., los corticoides y los diuréticos del asa en los casos de sobrecarga de volumen, insuficiencia cardíaca congestiva y en algunos casos de insuficiencia renal.
La depleción de volumen no es necesaria en la mayoría de las emergencias hipertensivas, a excepción de la gomerulonefritis difusa aguda (GNDA), porque en general son hiperreninémicas22-25.
Los fármacos que pueden ser utilizados (Tabla IV)
- Nitroprusiato de sodio: vasodilatador no específico del lecho arteriolar y venoso. En las células del músculo liso es metabolizado a su componente activo, el óxido nítrico, que activa a la guanilatociclasa, lo que genera la formación de GMPc y produce vasodilatación. Se inactiva por la luz y se debe preparar cada 4 horas. Los efectos adversos pueden deberse a la hipotensión.
- Labetalol: bloqueante simpático a y b que reduce la resistencia vascular periferica por bloqueo del efecto a 1. Se deben controlar los efectos metabólicos de la hiper/hipoglucemia.
- Esmolol: antagonista b selectivo; la dosis de carga es de 300-500 µg/kg en 1 minuto y la de mantenimiento de 25-300 µg/kg en 4 minutos, para poder titularla. Se hidroliza rapidamente en plasma y su vida media es de aproximadamente 30 minutos.
- Hidralazina: vasodilatador directo arteriolar; aumenta el volumen minuto cardíaco (VMC), el flujo sanguíneo renal (FSR), el flujo sanguíneo cerebral (FSC) y el esplácnico. Dosis máxima: 2 mg/kg. No se comercializa en la Argentina.
- Diazóxido: vasodilatador directo arteriolar. Se utiliza en bolo, tiene un efecto muy rápido y es difícil controlar la dosis-respuesta; se administra 1mg/kg y se titula cada 5-15 minutos. El efecto persiste alrededor de 12 horas y tiene una vida media plasmática de 17-31 horas. El 20% se elimina sin cambios por el riñón.
- Nicardipina: bloqueante cálcico.
- Nifedipina: bloqueante cálcico de acción rápida. Relaja el músculo liso arterial con poco efecto sobre el lecho venoso. Su administración es oral.
- Fentolamina: bloqueante a adrenergico. Produce vaso-dilatación y estimulación cardíaca refleja. Tiene una vida media de 19 minutos y el 13% se elimina sin cambios por la orina. Su preparación es incompatible con las soluciones salinas.
- Fenoxibenzamina: bloqueante a1 adrenérgico moderadamente selectivo.
- Dexmedetomidina: estimulante a2 central. Se lo utiliza como coadyuvante por inhibición de la liberación de neurotrasmisores a nivel presináptico y modulación del flujo iónico en el postsináptico. La administración comienza con una dosis IV de carga de 2,5-5 µg/kg en 30 minutos, para luego seguir con una infusión continua.
- Nitroglicerina: pequeñas dosis disminuyen la precarga y con dosis mayores caen la pre y poscarga. Se la debe preparar en envases de vidrio porque se adsorbe en las paredes de los recipientes de clorhidrato de polivinilo. Desarrolla tolerancia y puede producir bradicardia paradojal.
| TABLA IV Tabla de los principales fármacos utilizados en pacientes con HTA | |||||
| Droga | Ruta | Dosis | Acción | Tiempo de acción | Duración |
| Nitroprusiato de sodio | EV | 0,5 - 8 µg kg/min | Vasodilatador arteriolar y venoso | Inmediato | Segundos a minutos |
| Labetalol | EV | 0,25 - 2 mg/kg/h | Bloqueante simpático a y ß | 5 7 minutos | 2 3 horas |
| Esmolol | EV | 25 300 µg kg/min | bloqueante ß cardioselectivo | segundos | 10 30 minutos |
| Fentolamina | EV | 1 5 µg Kg/min | Bloqueante a | minutos | 10 20 minutos |
| Hidralacina | EV | 0,1 0,5 mg/kg | Vasodilatador directo arteriolar | 10 30 minutos | 4 12 horas |
| Enalaprilat | EV | 0,005 0,01 mg/kg/824h | Inhibidor enz. conversión | 15 minutos | 12 24 horas |
| Diazoxido | EV | Bolo 1 5 mg/kg | Vasodilatador directo arteriolar | 1 3 minutos | 18 24 horas |
| Nicardipina | EV | 1 3 µg kg/min | Bloqueante cálcico | minutos | 10 15 minutos |
| Nifedipina | V.O. | 0,25 0,5 mg/kg | Bloqueante cálcico | 20 30 minutos | 6 horas |
| Dex | EV | 0,4 -0,5 µg/kg/hora | Estimulante a 2 central | 20-30 minutos | 2-3 horas |
Conclusiones
El pronóstico ante un cuadro hipertensivo depende de un rápido diagnóstico y del tratamiento apropiado que lleve a la presión arterial dentro de valores adecuados para evitar la posible lesión de los órganos de choque.
Los vasodilatadores directos (nitroprusiato, nitroglicerina, diazóxido e hidralazina), los alfa y beta bloqueantes, los bloqueantes cálcicos, los alfa 2 estimulantes centrales y los inhibidores de la enzima de conversión, son algunos de los fármacos que hoy disponemos para poder controlar la HTA.
En general no se necesita agregar fármacos cuando se utilizan técnicas anestésicas balanceadas o combinadas y agentes inhalatorios halogenados, preferentemente isoflurano y drogas agonistas morfínicas potentes en la enfermedad hipertensiva. Pero cuando se presentan crisis, el empleo de distintos fármacos de nuestro arsenal se hace indispensable.
Bibliografía
- Miceli S, Aralde A. Hipertensión arterial en niños y adolescentes. En: Nefrología Pediátrica. SAP. Comité Nacional de Nefrología Pediátrica. Ed. Ideográfica. Bs As. 2003. 33:447-474.
- Lagomarsino E. Hipertensión arterial. Horizonte actual y responsabilidad del pediatra. Rev Chil Ped 1998; 69:227-235.
- Flynn J. Neonatal hypertension: diagnosis and management. Ped Nephrol 2000; 14:332-341.
- Alagappan A, Malloy MH. Systemic hypertension in very low-birth infant with bronchopulmonary dysplasia: incidence and risk factors. Am J Perin 1998; 15:3-8.
- Greenberg R, Waldman D, et al. Endovascular treatment of renal artery thrombosis caused by umbilical artery catheterization. J of Vasc Surg 1998;28(5):949-953.
- Green CY. Umbilical arterial and venous catheters: placement, use, and complications. Neonatal Network 1998;17(6):23-28.
- LeFlore JL, Engle WD, Rosenfeld CR. Determinants of blood pressure in very low birth weight neonates: lack of effect of antenatal steroids. Early Hum Dev. 2000 Jul;59(1): 37-50.
- Kasaragod AB, Lucia MS, Lum GM, Caldwell S, Stork L, Stenmark KR. Solitary renal myofibromatosis: an unusual cause of infantile hypertension. Pediatrics. 1999;103(5):66.
- Costello GT, Moorthy SS, Vane D W et al. Hypoglycemia following bilateral adrenalectomy for pheochromocytoma. Crit. Care Med. 1988; 16:562-563.
- Levin H, Heifetz M. Phaeochomocytoma and severe prostacted postoperative hypoglycemia. C. J. Anaesth. 1990; 37:477-478.
- Sagalowsky A, and Donohue J P. Possible mechanism of hypoglycemia following removal of pheochromocytoma. J. Urol 1980; 124:422-423.
- Wilkins G. E., Schmidt T. and Doll W. Hypoglycemia following excision of pheochromocytoma. Can. Med. Ar. J. 1977; 116:367.
- Masako A. et al. Hypoglycemia induced by excessive rebound secretion of insulin after removal of pheochromocytoma. WHO J. Surg. 1990; 14:317-324.
- Meeke RT, Okeefe JD, Gaffney JD. Pheochromocytoma removal and postoperative hypoglycemia. Anesthesia 1985; 40:1093-1096.
- Pesantes GJ, López CC, Robles VC, Valencia SG, Millote GG. Hiperplasia suprarrenal. Revisión de 10 años en el Instituto Nacional de Pediatría. Acta Ped Mex 2000; 21(5):136-141.
- Reich, DL; Bennett-Guerrero, E; Bodian, CA.; Hossain, S.; Winfree, W; Krol, M. Intraoperative Tachycardia and Hypertension Are Independently Associated with Adverse Outcome in Noncardiac Surgery of Long Duration. Anesth & Analg 2002; 95:273-277.
- 17.Alhashemi, JA. Reduction of vasopressor requirement by hydrocortisone administration in a patient with cerebral vasospasm. Br. J. Anaesth. 2001; 86:138-141.
- Kross, RA; Ferri, E; Leung, D; Pratila, M; Broad, C; Veronesi, M; Melendez, JA. A Comparative Study Between a Calcium Channel Blocker (Nicardipine) and a Combined á-â-Blocker (Labetalol) for the Control of Emergence Hypertension During Craniotomy for Tumor Surgery. Anesth Analg 2000; 91:904-909.
- Bruandet, N; Rentero, N; Debeer, L; Quintin, L. Catecholamine Activation in the Vasomotor Center on Emergence from Anesthesia: The Effects of á2 Agonists.Anesth Analg 1998; 86:240245.
- Hirsch, NP; Murphy, A; Radcliffe, J. Neurofibromatosis: clinical presentations and anaesthetic implications. Br. J. Anaesth. 2001; 86:555-564.
- Briones LM, Ramírez F. Tratamiento de la hipertensión arterial y de las crisis hipertensivas. En: Nefrología pediátrica. SAP. Comité Nacional de Nefrología Pediátrica. Ed. Ideográfica. Bs. AS. 2003.34:475-496.
- Adelman RD, Coppo R, Dillon MJ. The emergency management of severe hypertension. Ped Nephrol 2000; 14:422-427.
- Baner JH, Reams GP. Antihypertensive Drugs en: The Kidney. Brenner & Rector 5th. Ed. Saunders Co. USA.1998. Chap. 54.
- Garrido GML. Crisis hipertensiva en pediatría. Acta Ped Mex 1998;19(3):117-120.
- Tanaka K; Oshita S; Kitahata H; Kimura H; Kawahito S; Park YC; Sakabe T. Effects of nicardipine on ventriculo-arterial coupling in humans. Br. J. Anaesth. 1998; 81:180-185.