“La anestesia regional endovenosa es un método que se utiliza para producir analgesia en la parte distal de un miembro mediante una inyección intravenosa mientras la circulación se encuentra ocluida.”1.
Charles Mck. Holmes
Historia
En 1886 Alms2 publica sus observaciones sobre la administración de anestésicos locales mediante una inyección intravenosa, describiendo como dato interesante: “analgesia en el territorio de la misma”.
En 1908, August K.G. Bier, cirujano y asistente de J. Von Esmarch, presentó su método: “Anestesia regional endo-venosa” para provocar analgesia en un miembro.
La descripción original, efectuada en 134 pacientes, consignaba que: “… después de exanguinar el miembro afectado con una venda de Esmarch, se coloca un torniquete a cuatro dedos por encima de la articulación del codo y otro distal al sitio de la operación y se expone una vena superficial, que se canula, y se administran 100 ml de novocaína al 0,5% o 0,25%”3.
A pesar de adquirir notoriedad en su época, este método cayó en desuso y descrédito debido a la incidencia de complicaciones derivadas de la liberación de novocaína en el torrente sanguíneo.
Sin embargo, en 1936 Holmes reintroduce la técnica de August Bier; Adams, en 1944 confecciona un artículo de revisión; en 1955 Momburg modifica la técnica con su doble torniquete hemostático, y en 1963 Holmes genera el gran avance al utilizar lidocaína, otorgándole a la técnica la confiabilidad y predecibilidad que conserva hasta el presente.
De manera tal que, casi cien años después, podemos afirmar que los pasos y detalles descritos por A. Bier son hoy prácticamente los mismos.
Mecanismo de acción
Bier describía un comienzo de acción rápida en las terminales nerviosas, cerca del lugar de la inyección, y luego un bloqueo más profundo en los troncos nerviosos.
Estudios posteriores4 en los últimos treinta años dieron sustento a la teoría de Bier y sumaron otros componentes, como el efecto producido por la oclusión del torniquete y la hipoxia tisular.
A pesar de la presencia de válvulas unidireccionales en el sistema venoso, es posible inyectar una solución en el sistema venoso superficial y llegar al sistema venoso profundo con un volumen de 20 ml por minuto y 90 mmHg de presión. La difusión del anestésico local se produce en forma centrípeta. Sólo el nervio intercostobraquial no se incluye en el bloqueo, por lo que debe ser bloqueado especí-ficamente en forma subcutánea en la axila, para evitar de esta manera la intolerancia al primer torniquete.
En estudios radiográficos4 se observó una fase inicial de analgesia en las terminales nerviosas y luego una distribución a una estancia media en el área antecubital.
La dirección del bloqueo en todos los trabajos indica la progresión del mismo del extremo distal al proximal, con mayor efectividad en el territorio del nervio mediano y radial, siendo menor en el territorio del nervio cubital. Esto se relaciona con el tamaño de los troncos nerviosos.
La liberación del torniquete produce una total recuperación antes de los 15 minutos. La isquemia, asociada a la asfixia tisular es una condición necesaria para el bloqueo de Bier.
De esta manera, y a la luz de los resultados de los diferentes estudios, la anestesia y analgesia se producen por múltiples mecanismos:
- el bloqueo de las pequeñas terminales nerviosas
- el bloqueo de los troncos nerviosos próximos al sitio de inyección
- la isquemia (bloqueo de la conducción nerviosa y la placa neuromuscular)
- la compresión de los troncos nerviosos (mecanismo lento).
Las fibras C amielínicas no se bloquean durante la insuflación del torniquete. Ellas son responsables del impacto nociceptivo que a su vez se incrementa por la hipoxia y la compresión (Teoría de Melzack, de la sopa sensibilizante)5-7. El conocimiento de este mecanismo fundamenta la analgesia preventiva o anticipada.
El uso de clonidina o clorhidrato de ketamina en el bloqueo de Bier reduce este impacto nociceptivo8-13.
La clonidina prolonga la acción de los anestésicos locales en los nervios periféricos por la vasoconstricción que produce e inhibe el impulso de conducción, específicamente de las fibras C.
El clorhidrato de ketamina bloquea los receptores NMDA y otros receptores asociados al glutamato, evitando la actividad aferente en las fibras nerviosas.
Las dosis recomendadas como coadyuvantes del bloqueo junto al anestésico local son de 1 mcg/kg para la clonidina y 0,1 mg/kg para el Cl. de ketamina. Con la teoría neuro-fisiológica de Melzack se puede dar respuesta a una situación que es patognomónica de la eficacia del bloqueo: la “sensación de mano en alto” o de “miembro fantasma”.
Las teoría de Bromage y de Melzack concuerdan en que es producto de una completa desaferentación y está dada por la falta total de propiocepción.
Indicaciones
En Estados Unidos14 y Canadá, el bloqueo de Bier es una técnica ampliamente utilizada en centros especializados en cirugía de miembro superior y mano. Solamente en el Reino Unido se realizan más de 7000 bloqueos de Bier por año.
En nuestro Centro, ya hace más de quince años que se utiliza este método de rutina en el 90% de los casos de cirugía ambulatoria, lo que representa aproximadamente 1500 procedimientos por año.
El bloqueo de Bier es indicado en todo tipo de cirugía y/o procedimiento terapéutico (Tabla I), por debajo del torniquete, ambulatorio o internado, de urgencia o programado, que involucren uno o los dos miembros, y cuando la duración del procedimiento no exceda el tiempo dado por la tolerancia al torniquete.
Como otras técnicas de anestesia regional, es de elección en pacientes con estómago ocupado que por la urgencia de la patología no pueden aguardar las horas de ayuno, y también en aquellos que prefieren permanecer despiertos y no perder el control de la situación.
Si bien la duración del procedimiento está limitada por el tiempo de isquemia, existe la posibilidad de realizar un bloqueo continuo, respetando los tiempos de revascularización apropiados.
| TABLA I | |
| Indicaciones quirúrgicas | |
|
Técnica estándar
La entrevista preoperatoria es fundamental; en ella explicamos detalladamente el procedimiento al paciente, quien deberá dar su consentimiento para lograr su confianza y colaboración durante el desarrollo del mismo.
Consideramos indispensable que el anestesiólogo que administra la técnica esté calificado para tal fin, y por lo tanto, familiarizado con los posibles efectos adversos de los agentes anestésicos sobre el sistema nervioso y corazón.
La técnica debe ser administrada siempre en el ámbito de quirófano, equipado adecuadamente y bajo monitorización permanente.
El prebloqueo debe realizarse con:
- elección adecuada del paciente
- monitoreo mínimo: ECG- presión arterial-oximetría de pulso
- venopuntura en miembro contralateral con vía de administración permeable.
- chequeo del doble torniquete hemostático
- suficientemente acolchado
- conexiones sin pérdidas
- perfecto funcionamiento, alarmas
- equipamiento de reanimación completo
- drogas coadyudantes y de reanimación.
El paciente estará en posición decúbito dorsal con ambos miembros superiores libres. En el brazo contralateral al que se va a realizar la cirugía se coloca una venopuntura de teflón descartable. Se establece un plan de hidratación para la premedicación y la administración de las drogas coadyu-dantes necesarias. El paciente debe encontrarse confortable en la mesa de operaciones.
 |
| Fig. 1: Los torniquetes deben ser colocados próximos a la axila. |
Premedicación
Es fundamental la sedación del paciente y su colaboración.
Se aconseja la utilización del diazepam con el fin de aumentar el umbral ante posibles convulsiones a dosis de 0,1 mg/kg, pero, considerando que es un procedimiento para cirugía ambulatoria, puede utilizarse también el midazolam en dosis de 0,05 mg/kg.
La prevención de vómitos se realiza con la administración de metoclorpramida a razón de 0,2 mg/kg - ranitidina 2 mg/kg. La analgesia y sedación, con fentanilo 0,5 a 2 mg/kg dosis.
Se procede a la infiltración subcutánea de 5 ml de AL para el bloqueo del nervio intercostobraquial.
Colocación de los torniquetes
La elección de los torniquetes guarda una importante relación con el diámetro y el largo del brazo. Deben ser un 40% mayores que el diámetro del brazo y tener un ancho de 5 a 6 cm. Cuanto más angostos sean, menor será la superficie para ejercer presión sobre los tejidos subyacentes, lo que causará mayor incomodidad e intolerancia al torniquete.
En el mercado existen numerosos modelos de torniquetes neumáticos: simples, dobles, o de una sola pieza, pero con dos bandas insuflables (utiliza el espacio de un solo torniquete, pero son dos). Los aparatos electrónicos con evaluación permanente de la presión de insuflado y alarma son altamente seguros y confiables.
Si no se cuenta con aparatos electrónicos ad hoc, se puede recurrir a los torniquetes con relojes anaeroides. Es fundamental tener la certeza de que se encuentren en perfecto estado de funcionamiento. Se recomienda no clampearlos para poder medir constantemente la presión y hermeticidad del sistema.
Para ser suficientemente segura y eficaz, la técnica requiere siempre de dos torniquetes o de uno doble.
La piel debe ser protegida con vendas suaves, que a su vez mejorarán la adaptación de los torniquetes al contorno del brazo.
La presión de insuflación de los torniquetes neumáticos es motivo de discusión. Algunos trabajos postulan una cifra estándar de 100 mmHg por encima de la presión sistólica, habiéndose demostrado que 50 mmHg es suficiente en pediatría.
En general sugerimos una presión de 250 mmHg para el miembro superior, 300 mmHg para el inferior y 230 mmHg en pediatría.
Los torniquetes deben ser colocados próximos a la axila (Figura 1).
Si los torniquetes son dos, debe tomarse la precaución de que no quede espacio entre los mismos, caso contrario puede haber pérdida hemática en el campo quirúrgico cuando se cambia un torniquete por otro. Una manera de evitar esto es insuflar el segundo torniquete 20 a 25 mmHg por sobre el primero, antes de liberar a éste.
Debe guardarse especial cuidado en no colocar el torniquete sobre la articulación del codo, ya que los nervios podrían ser comprimidos y dañados dada su proximidad al hueso.
El tiempo de insuflado está dado por el tiempo de isquemia y el posible daño que la misma produce, siendo de alrededor de 1,5 a 2 horas.
Se recomienda no utilizar esta técnica en individuos con brazos de diámetro superior a los 35 cm.
Inserción del catéter para el bloqueo
Para la inyección intravenosa del agente anestésico se utiliza un catéter de teflón descartable y de bajo calibre, n° 22 G ó 20 G, luego de la asepsia y antisepsia de la zona, buscando el lugar más distal del torniquete. Se debe tener siempre la precaución de que no coincida con la zona de incisión del cirujano, pues la cercanía al torniquete puede favorecer la permeabilidad del agente anestésico hacia la circulación por aumento de presión de la solución inyectada y el volumen del sistema venoso.
Como hemos consignado anteriormente, por la evolución del bloqueo de distal a proximal y por las pequeñas terminaciones nerviosas a grandes troncos, tampoco tendría sentido utilizar los grandes vasos antecubitales. Nosotros los hemos utilizado para realizar estudios clínicos comparativos, observando que se retrasa el tiempo de inicio quirúrgico con el método del pinprick, que no se obtiene ninguna ventaja y que se favorece la ocurrencia de efectos adversos (pasaje a torrente sanguíneo del anestésico y campo congestivo para el cirujano). La elección de una vena distal disminuye el número de fallas de 4,1% a 22,7% que cuando la vena elegida es la antecubital.
 |
| Fig. 2: Cánula de teflón colocada distal en el dorso de la mano. |
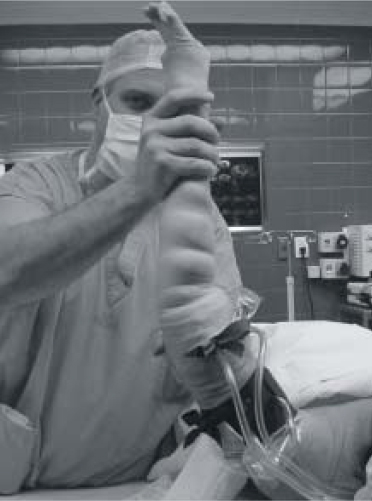 |
| Fig. 3: Insuflar el torniquete proximal en primer término, luego se retira la venda de Esmarch. Miembro exanguinado, listo para ser bloqueado. |
Debe tenerse la precaución de fijar siempre el catéter antes de retirar el mandril. Puede conectarse una prolongación al mismo o adaptar directamente las jeringas.
Para la técnica de bloqueo continuo, la cánula de teflón debe permanecer en su lugar con la debida fijación. Todos estos procedimientos deben realizarse bajo asepsia estricta (Figura 2).
Exanguinación
Es recomendable elevar el miembro a 90° por el término de 2 a 3 minutos y luego proceder a la exanguinación con la venda de Esmarch de distal a proximal, manteniendo esta posición.
Si por el propio efecto de la patología fuera imposible el pasaje de la venda de Esmarch, puede hacerse la exan-guinación solamente con el brazo o pierna elevados, o pasar la misma suavemente por la zona dolorida y luego exanguinar enérgicamente. Una mala exanguinación puede causar falla parcial en la técnica.
Se procede a insuflar el torniquete proximal (más cercano a la cabeza del paciente) en primer término; luego se retira la venda de Esmarch, quedando de esta manera el miembro exanguinado y listo para ser bloqueado (Figura 3).
Inyección de la solución anestésica
Una vez constatada la estabilidad del insuflado del primer torniquete proximal, se procede a inyectar la solución anestésica elegida con un volumen de 40 a 50 ml para el miembro superior y de 60 a 80 ml para el miembro inferior.
Siempre debe realizarse con el brazo horizontal y con una velocidad de inyección de 3 ml/seg si es distal y de 2 ml/seg si es cerca del torniquete.
La velocidad de inyección no debe ser inferior a 90 segundos, para asegurarse que la presión generada con la inyección sea limitada (Figura 4).
 |
| Fig. 4: La velocidad de inyección no debe ser inferior a 90 segundos. |
La presión venosa durante la inyección depende del volumen, de la velocidad de inyección y del by-pass entre el sistema venoso superficial y el sistema profundo.
Anestésico local
El agente anestésico ideal es aquél que a bajas concentraciones puede usarse a grandes volúmenes sin efectos adversos indeseables, y que tiene un rápido inicio de acción y pocos efectos hemodinámicos, una vez liberado el torniquete.
La droga “ideal” no existe. Por lo tanto, presentamos una lista de muy buenas opciones15 (Tabla II). La lidocaína al 0,5%-0,4% ha sido la droga más utilizada y con menores efectos adversos.
Entre los años 1979-1983 se reportaron en el Reino Unido 7 casos de paro cardíaco con el uso de bupivacaína al 0,25% en pacientes sin antecedentes previos, tras una serie de 14.000 IVRA16,17. Esos eventos adjudicados a la droga que cayó en desuso y no es más recomendada.
La droga más cercana a la “ideal” es la prilocaína, no disponible en Argentina. Es un éster que se hidroliza en sangre y que prácticamente no tiene efectos adversos de consideración a las dosis utilizadas.
El dosaje de las concentraciones plasmáticas de anestésico local en el miembro contralateral15 luego de la liberación de torniquete fue de:
- lidocaína: 1,5 a 2,0 mcg/ ml
- prilocaína: 1,5 a 2,0 mcg/ ml
- bupivacaína: 0,8 a 1,6 mcg/ ml.
fase alfa: 8 a 10 minutos
fase beta: 108 minutos.
Con respecto a las amidas se están estudiando la ropi-vacaína como droga con menor tiempo de latencia, mayor bloqueo motor y más tiempo de analgesia posoperatoria, pero aún se encuentra en fase de investigación clínica.
Características del proceso anestésico
De menor a mayor frecuencia son:
- calor
- hormigueo
- decoloración en parche de la piel
- después de 3 a 5 minutos: entumecimiento/insensibilidad
- parálisis motora (se produce siempre)
- recorrido de pequeños nervios muñeca- antebrazo-dedos-codo.
| TABLA II | ||||
| Anestésicos Locales | ||||
| Concentración | Volumen | Dosis | Efectos adversos | |
| Prilocaína: | 0,5% a 1% | 40-50 ml | 3-4 mg/kg | metaglobinemia |
| Lidocaína: | 0,5% a 0,25% | 40-50 ml | 3 mg/kg | |
| Bupivacaína: | 0,25% a 0,5% | 40-50 ml | 1,5 a 3 mg/kg | arresto cardíaco |
| Cloroprocaína: | 0,25% a 2% | 40-50 ml | 8 mg/kg | tromboflebitis |
| Levobupivacaína: | 0,125% | 40-50 ml | 2 mg/kg | |
| Ropivacaína: | 0,2% a 0,375% | 40-50 ml | 1,2 a 1,8 mg/kg | |
Si la técnica de elección no es la continua, luego de la inyección del agente anestésico y sus coadyudantes se debe retirar el catéter y realizar compresión venosa en el sitio de la venopuntura por el término de un minuto, para evitar la formación de un hematoma en la zona de la punción.
Duración y efectividad del torniquete
Hay una gran variabilidad en cuanto a la tolerancia al primer torniquete, que depende de la sumatoria de las siguientes causas:
- umbral al dolor del paciente y experiencias previas
- concentración y dosis de las drogas preanestésicas
- bloqueos para tolerancia a los torniquetes
- acolchonado de la piel debajo de los torniquetes
- tipo de torniquete.
Se pueden agregar narcóticos, analgésicos o realizar una anestesia ligera (N2O) en un intento por mejorar la tolerancia al segundo torniquete.
Liberación de los torniquetes
Existen varias teorías sobre la forma de realizar esta maniobra. Nosotros observamos que el tiempo mínimo de insuflado del torniquete debe ser como mínimo de 30 minutos, ya que, por la cinética de los agentes anestésicos, el 50% ya está metabolizado o adherido a tejidos que lo liberarán en forma lenta y progresiva. Esta es la razón por la que se recomienda no movilizar el miembro al que se le liberó el torniquete por el término de 15 o 20 minutos, tratando de no acelerar la liberación del anestésico desde los tejidos al torrente sanguíneo.
Se destaca que la sensibilidad se recupera en pocos minutos y la movilidad entre 2 y 8 minutos, según el agente elegido, y que carece totalmente de analgesia residual.
La baja dosis utilizada para realizar el bloqueo, el recurso de no liberar antes de los 30 minutos y la cinética de los anestésicos en su fase de eliminación, nos lleva a considerar que no hay mayores inconvenientes en liberar el torniquete en un tiempo.
Autores sudamericanos18,19 preconizan la liberación con dosis de testeo por 5 segundos y reinsuflando por 30, durante un período de 3 minutos, llevando después el tiempo de desinflado a 1 minuto, durante otros 3 a 4 minutos.
Nosotros sostenemos que esta técnica de desinsuflación debe practicarse sólo en aquellos pacientes graves o en los casos en que se presentan algunos de los síntomas correspondientes a altos niveles sanguíneos de anestésicos locales, como tinutus, sabor metálico en la boca, diplopía, temblor, etc.
Otra técnica de desinsuflación es la utilización de un tercer torniquete que se coloca en el antebrazo. Es una forma de sectorizar las zonas que irán liberando y dosificando el agente anestésico vertido al torrente sanguíneo. Es imposible practicar esta maniobra en una cirugía que involucre el antebrazo. La forma de liberación ofrecería un 15% del agente anestésico en lugar del 30% que se libera con la técnica de los dos torniquete18-21.
Antes de la liberación, se debió anticipar la analgesia utilizando una o varias alternativas:
- por vía sistémica
- infiltración de tejidos
- otro tipo de bloqueos analgésicos
- analgesia preventiva o anticipada.
Fue descrita en el año 1969 por Brown16.
El catéter intravenoso deberá permanecer en su sitio bajo normas de antisepsia estrictas conectado a un prolongador con heparina: cantidad 5000 UI en 1 ml.
Luego de las dos horas de insuflado, se procede a liberar el torniquete para permitir la oxigenación de los tejidos durante 10 minutos. El cirujano vuelve a exanguinar la extremidad con una venda de Esmarch estéril y se insufla nuevamente el torniquete proximal, inyectando en esta oportunidad sólo el 50% de la dosis inicial.
Esta técnica ha sido utilizada en cirugías de hasta 5 horas por Raj y col., quienes la presentaron en al Annual Meeting ASA del año 198722.
Durante el proceso de recirculación, el paciente deberá permanecer sedado y con una analgesia importante, la suficiente como para poder tolerar el proceso, en tanto que la analgesia del primer bloqueo desaparecerá o será mínima. Con el objeto de mejorar la isquemia de los tejidos, se administra metil-prednisolona por vía endovenosa a altas dosis (3 mg/kg)23.
Distrofia simpática refleja
El método y la indicación fueron descritos por Hannington-Kiff en 19743. Debido a que los pacientes deben ser sometidos regularmente a procedimientos de movilización bajo anestesia, se utiliza 20 mg de guanetidina acompañada con lidocaína 0,5%, o también otras drogas que bloquean la liberación de norepinefrina, como 1,25 mg de reserpina y el 1,5 mg/kg de bretilio (no disponible en la Argentina).
En nuestro servicio tenemos experiencia con esta técnica; administramos ketorolac 30 mg más metil-prednisolona 40 mg como coadyudante del bloqueo, dado que esta combinación de drogas no presenta tanta incidencia de hipotensión como la guanetidina al liberarse el torniquete10,23.
En pacientes con esta patología pueden presentarse problemas en la búsqueda de la vena para insertar el catéter para realizar el bloqueo, lo que es posible superar utilizando nitroglicerina en forma local como vasodilatador.
El proceso se repite con una frecuencia de 2 a 7 días para movilización bajo anestesia, y se utilizan drogas bloquea-doras cada 20 días.
Es para destacar que con este tratamiento se disminuyen considerablemente los requerimientos de antidepresivos y anticonvulsivantes, ya que la VAS se reduce inmediatamente a límites tolerables.
Ventajas y desventajas
Tiene pocas contraindicaciones y presenta múltiples ventajas.
Se puede realizar en pacientes desde los 14 kg de peso (2 años de edad) en adelante, sin límite de edad superior24-26. No tiene restricción en cuanto al estado ASA preoperatorio.
La necesidad de drogas suplementarias es mínima. Es posible prolongar los tiempos con un bloqueo continuo.
En lo referente a los costos de realización de las diferentes técnicas, anestesia general, bloqueo axilar e IVRA, ha quedado demostrado que el tiempo de internación en el bloqueo regional endovenoso es el menor de todos, con una mínima incidencia de efectos adversos y menor costo económico27.
Es bien aceptada por los pacientes. Prácticamente no existen complicaciones cuando se la compara con otros bloqueos en los que podrían producirse lesiones nerviosas, neumotórax, etc. Si bien existe posibilidad de toxicidad sistémica, su incidencia es muy baja.
Presenta rápido onset y offset entre los 5 a 10 minutos, dependiendo de la droga elegida y la sumatoria de coadyudantes. Es una técnica muy efectiva3,27. En series numerosas de más de 10000 casos, los casos exitosos superan siempre el 96%, llegando al 99% en otros casos14.
Es una técnica de fácil realización que no requiere de un conocimiento anatómico específico de los nervios y de los plexos, ya que se inicia con la sola canulación de una vena superficial.
La duración de la acción está dada por la permanencia del torniquete. Se recuerda no retirarlo antes de los 30 minutos y no exceder las 2 horas por el tiempo máximo de tolerancia a la isquemia.
La relajación muscular se produce siempre y está relacionada con el tiempo de isquemia, la compresión de los nervios y el bloqueo anestésico. El tiempo de inicio varía por tipo y concentración de la droga.
La recuperación a corto plazo permite una rápida evaluación de la función neurológica del miembro sometido a cirugía.
Desventajas y complicaciones
Debido a la rápida recuperación de la sensibilidad, es imperiosa la necesidad de realizar técnicas de analgesia en forma anticipada por via sistémica, y bloqueos o infiltración con el fin de evitar el impacto nociceptivo al liberar el torniquete, ya que el bloqueo desaparecerá a los 2 a 5 minutos.
La toxicidad sistémica es una complicación poco frecuente 1,6%3,16,27, siendo mínima la posibilidad con las técnicas de reinflado escalonado o tercer torniquete. Sólo por falla del torniquete puede producirse una reacción tóxica grave (desinsuflación a menos de 20 minutos).
El tiempo de permanencia del torniquete está determinado por el tiempo de isquemia y no por la técnica en sí. Ya observamos anteriormente que es posible realizar una IVRA de hasta 5 horas respetando el tiempo de reperfusión.
Lecho venoso y hemostasia
Destacamos que las venas pueden ser visualizadas, ya que contienen el volumen del agente anestésico inyectado, lo cual permite realizar la hemostasia adecuada.
En cuanto al tejido óseo, es imposible exanguinarlo, pero el campo quirúrgico es igualmente aceptable.
Contraindicaciones
Absolutas
- Hipersensibilidad a los agentes anestésicos
- Negación del paciente a la técnica
- Enfermedad de Sickle
- Celulitis local en el sitio de punción.
- Bloqueos cardíacos no tratados y combinados hasta 3
- Desórdenes en la coagulación
- Desórdenes neurológicos progresivos
- Desórdenes hepáticos
- Pacientes que no colaboran (psicosis–demencias)
- Convulsiones no tratadas.
Protocolo de procedimiento
- Preoperatorios
- Técnica
- Postoperatorios.
- Elección del paciente
- Elección de la técnica
- Consentimiento del paciente
- Chequeo del equipamiento:
- ECG
- Oximetría de pulso
- TAM no invasiva continua
- Doble torniquete hemostático
- Equipamiento de reanimación.
- Colocar venopuntura en miembro contralateral
- Monitorear permanentemente
- Premedicar
- Colocar acolchamiento sobre la piel, debajo del torniquete
- Colocar torniquetes próximos a la axila
- Realizar venopuntura con catéter de teflón n° 22 G descartable
- Retirar el mandril y fijar
- Elevar el miembro a 90° durante 2 minutos
- Realizar exanguinación con venda de Esmarch de polo distal a proximal
- Insuflar el torniquete proximal a 100 mmHg por sobre la presión sistólica del paciente (no superar los 300 mmHg)
- Retirar la venda de Esmarch
- Colocar el miembro en posición horizontal
- Inyectar solución anestésica a razón de 2 ml/seg
- Retirar catéter de teflón y compresión local
- Cambio de torniquetes proximal por distal entre los 20 a 45 minutos
- Desinflar el torniquete a las 1,5-2 horas
- Analgesia sistémica y local anticipada.
- Control permanente en los siguientes 30 minutos a la liberación del torniquete
- Analgesia postoperatoria reglada
- Evaluación y resolución de posibles efectos adversos.
Actualización y discusión
Choyce et al10, en un interesante meta análisis, concluye que los coadyudantes pueden mejorar la eficacia y perfomance del bloqueo, proveer una mayor tolerancia al torniquete y/o favorecer la analgesia postoperatoria. Nosotros preferimos tomar las ventajas de cada una y combinarlas.
En el listado de drogas coadyudantes en el meta-análisis se incluyen:
- Opioides
- Fentanilo: 50-200 mcg
- Meperidina:10-100 mg
- Morfina: 1-6 mg
- Sufentanilo: 25 mcg
- Tramadol: 100 mg.
- AINES
- Ketorolac: 5-60 mg
- Tenoxican: 20 mg
- AAS: 90 mg.
- Otras drogas
- Clonidina: 1-2 mcg/kg
- Relajantes musculares: atracurium 2 mg, mivacurium 0,6 mg y pancuronio 0,05 mg.
- Neostigmina: 0,5-1 mg
- Alcalinización con bicarbonato de sodio
- Aumento de la temperatura de la solución.
La evidencia encontrada permite recomendar, dentro de las drogas coadyudantes: AINES en general y ketorolac 60 mg en particular, para analgesia intra y postoperatoria.
La clonidina en dosis de 1 mcg/kg prolonga el tiempo y la tolerancia al torniquete. Los opioides tienen un pobre efecto por esta vía de administración, y la mejor opción sería la meperidina en dosis de 30 mg, otorgando analgesia postoperatoria importante, pero a expensas de posibles vómitos y náuseas.
Los relajantes musculares no mejoran el bloqueo motor, que se produce de todas maneras, ni disminuyen el tiempo de inicio.
La alcalinización está indicada únicamente para la prilocaína 0,5 mEq por cada 10 ml de solución; los estudios no fueron significativos para el resto de las drogas estudiadas.
Se comprobó que la elevación de la temperatura, equiparada a la temperatura corporal, no arrojó resultados significativos.
En un trabajo reciente de Dilek-Menis et col.5 los autores utilizan dexmetomidina a 0,5 mcg/kg con 40 ml de lidocaína al 0,5%. La justificación científica para la elección de esta droga es que su afinidad por los alfa 2 adenorreceptores es ocho veces mayor que la de la clonidina a nivel del asta dorsal de la médula, y que inhibe la sustancia P en la vía nociceptiva.
La administración de dexmetomidina en el preoperatorio disminuye los requerimientos de opioides en el intra y postoperatorio, y en dosis de 0,25-0,5 y 1 mcg/kg disminuye notoriamente la intolerancia al torniquete. La dosis más efectiva (sin efectos adversos) fue la de 0,5 mcg/kg.
Como analgesia preventiva y por vía sistémica se pueden utilizar distintas drogas, como el clorhidrato de ketamina a 0,1 mg/kg o 2,5 mcg/kg/minuto, la lidocaína a 1 mg/kg y la clonidina a 1 mcg/kg28-30.
Los mejores resultados se consiguen con el clorhidrato de ketamina en dosis bajas, sin incidencia de efectos colaterales, con muy buena tolerancia al torniquete y analgesia postoperatoria. Actúa bloqueando los receptores NMDA periféricos, asociados a las fibras C. El clorhidrato de ketamina se combina satisfactoriamente con la lidocaína por vía sistémica y/o en el bloqueo. Entre otros efectos, esta asociación permite disminuir las dosis requeridas de opioides por vía sistémica.
Nosotros realizamos estudios clínicos prospectivos comparativos randomizados doble ciego cuyos resultados aún no hemos publicado. En un grupo, comparando ketorolac 60 mg con meperidina 30 mg , observamos un resultado analgésico significativo en el grupo meperidina en cuanto a la tolerancia al primer torniquete, pero con mayor incidencia de efectos adversos como náuseas y somnolencia. De acuerdo con nuestros resultados, preferimos la utilización de 30 mg de ketorolac combinado con el AL intravenoso y los morfinosímiles por vía sistémica asociados a la infiltración de la herida.
Con respecto a los agentes anestésicos locales, hemos utilizado lidocaína 0,5%, prilocaína 0,5% y ropivacaína a 0,2 y 0,375% con resultados excelentes y sin diferencias significativas entre los grupos de estudio. En el grupo prilocaína no se presentaron efectos adversos, si bien los 20 casos estudiados son aún insuficientes.
El análisis de costos de esta técnica en nuestro país coincide con el realizado por Chan27, que comparó tres técnicas para cirugías de mano donde todos los ítem analizados fueron favorables para el bloqueo regional intravenoso.
El mayor inconveniente económico en nuestro país está dado por el costo de los torniquetes electrónicos, lo que puede ser compensado por el corto tiempo de recuperación, el rápido giro cama, la baja incidencia de horas cama por médico/enfermera, la casi nula medicación postoperatoria y la posibilidad de realizar múltiples intervenciones en el mismo día en forma ambulatoria-hospital de día.
El bloqueo regional endovenoso es una excelente alternativa para la cirugía de miembros, con buena aceptación y confort por parte del paciente. Es ideal para ser utilizado en procedimientos ambulatorios y en urgencias, con un alto grado de seguridad y eficacia.
La técnica que nos ocupa está especialmente indicada para la cirugía de urgencia y ambulatoria.
En el Servicio de Cirugía de Miembro Superior al que pertenecemos se efectuaron desde el año 1995 un total aproximado de 3000 anestesias con bloqueos de Bier.
En el presente trabajo nos referimos a las experiencias debidamente registradas y con la documentación científica correspondiente.
Agradecimientos
A quien fuera durante más de 14 años el impulsor de esta técnica en la República Argentina en forma interrumpida, nuestro querido amigo y maestro Dr. Alberto Carlos Galeppi. Nos honra el privilegio de sabernos los continuadores de su enseñanza y su escuela.
Bibliografía
- Holmes C McK. The history and development of intravenous regional anesthesia. Acta Anestesiolo. Scand 1969, 36, suppl: 11.
- Hilgenhurst G. The Bier block after 80 years: A historical review. Reg Anesth 1990;15:2-5.
- Cousins MJ, Bridenbaugm PO. “Neural Blockade”. Lippinscott – Raven. New York (1998): 3-25; 55-81; 97-128; 395-409.
- Rosenberg P. “Intravenous regional Anesthesia:Nerve Block by Multiple Mechanisms” ASRA. Lecture regional Anesthesia. 1993,18:1-5.
- Memis D, Turan A, Karamanlioglu B, Pamukcu Z, Kurt I. Adding dexmedetomidine to lidocaine for intravenous regional anesthesia. Anesth Analg. 2004 Mar, 98 (3): 835-40.
- Estebe JP, Gentili ME. Phantom limb sensation and intravenous regional anesthesia. Reg Anesth Pain Med. 2001, Nov-Dec; 26 (6): 591-2.
- Melzack R. “Del Umbral a la Neuromatriz”, Revista Española Dolor 2000;7:149-156.
- Reuben SS, Sklar J. Intravenous regional anesthesia with clonidine in the management of complex regional pain syndrome of the knee. J Clin Anesth. 2002 Mar; 14 (2): 87-91.
- Schmid RL et al “The Stability of a ketamine–Morphine Solution”, Anesth. Analg. 2002; 94:898-900.
- Choyce A, Peng P. A systematic review of adjuncts for intravenous regional anesthesia for surgical procedures. Can J Anaesth. 2002 Jan; 49 (1): 32-45. Review.
- Gentili M, Bernard JM, Bonnet F. Adding clonidine to lidocaine for intravenous regional anesthesia prevents tourniquet pain. Anesth Analg. 1999 Jun; 88 (6): 1327-30.
- Gorgias NK, Maidatsi PG, Kyriakidis AM, Karakoulas KA, Alvanos DN, Giala MM. Clonidine versus ketamine to prevent tourniquet pain during intravenous regional anesthesia with lidocaine. Reg Anesth Pain Med. 2001 Nov-Dec; 26 (6): 512-7.
- Reuben SS, Steinberg RB, Klatt JL, Klatt ml. intravenous regional anesthesia using lidocaine and clonidine. Anesthesiology. 1999 Sep; 91 (3): 654-8.
- Henderson CL, Warriner CB, McEwen JA, and Merrick PM. A North American Survey of intravenous regional Anesthesia. Anesth Analg 1997; 85:858-63.
- Chan VW, Weisbrod MJ, Kaszas Z, Dragomir C. Comparison of ropivacaine and lidocaine for intravenous regional anesthesia in volunteers: a preliminary study on anesthetic efficacy and blood level. Anesthesiology. 1999 Jun; 90 (6): 1602-8.
- Brown EM; McGriff JT; Malinowski RW. intravenous regional anaesthesia (Bier block): review of 20 year´s experience. Can J Anaesth May 1989 36 (3) pp. 307-10.
- Holmes CK. Intravenous regional analgesia. Lect Anaesthesiol 1986 (2) pp. 13-23.
- Marques A. Anestesia regional intravenosa versus bloqueo plexo braquial (vía axilar). Rev Soc Portug Anestesiol Abr 1992 4 (1) pp. 39-46.
- Boscan NG: “Liberación del torniquete en dos tiempos. Rev. Colombiana Anestesiologia. Julio-Septiembre 1993,21 (3):201-5.
- Perlas A, Peng PW, Plaza MB, Middleton WJ, Chan VW, Sanandaji K. Forearm rescue cuff improves tourniquet tolerance during intravenous regional anesthesia. Reg Anesth Pain Med. 2003 Mar-Apr; 28 (2): 98-102.
- Valley MA; Polanco JC. intravenous regional anesthesia. Probl Anesth June 1994 8 (2) pp. 218-30.
- Raj P. intravenous regional anesthesia: past, present and future. En: 38th Annual Refresher Course Lectures and Clinical Update Program. Atlanta.1987:422.
- Ananthanarayan C, Castro C, McKee N, Sakotic G. Compart-ment syndrome following intravenous regional anesthesia. Can J Anaesth. 2000 Nov; 47 (11): 1094-8.
- Coté, Ryan, Todres. Goudsouzian. “Anestesia en Pediatría”. Interamericana. Mc Graw – Hill. México (1995): 463-483.
- Dalens B. “Regional Anestesia in Infants,Children,and Adolescents”. London. Williams and Williams, (1995):550.
- Paladino MA; Mercuriali A; Tomiello F; Santilli R. Anestesia regional endovenosa de Bier, casi un siglo después. Rev Arg Anestesiol Sep 1995, 53 (Suppl) pp. 68-74.
- Chan VW, Peng PW, Kaszas Z, Middleton WJ, Muni R, Anastakis DG, Graham BA. A comparative study of general anesthesia, intravenous regional anesthesia, and axillary block for outpatiente hand surgery: clinical outcome and cost analysis. Anesth Analg. 2001 nov; 93 (5): 1181-4.
- Paladino MA. Anestesia regional endovenosa de Bier. En: Actas/XXIII Jornadas Argentinas de Anestesiología. Salta.1996; 522.
- Schmid RL et al:”Use and Efficacy of Low dose ketamine in the Management of Acute Postoperative Pain: a Review of current Technique and Outcome” Pain 82 (1999):111-125.
- Alison CM: “A single infusión of I.V.ketamine improves Pain relief in patients with critical limb isquemia”. Pain 2002; 97:275-281.