Introducción
La adición de bicarbonato de sodio a los anestésicos locales ha sido recomendada para acortar el período de latencia y mejorar la calidad del bloqueo motor y sensorial, lo que resulta en una analgesia más eficiente1,2. Sin embargo, no se ha determinado la neurotoxicidad causada por el cambio de pH y la osmolaridad de la mezcla anestésica. En el siguiente informe se describen dos casos de pacientes en los cuales se diagnosticó síndrome de cauda equina y aracnoiditis, en los que la inyección de lidocaína alcalinizada fue instilada en forma accidental en la zona adyacente a una punción del saco dural con la consiguiente aparición de signos de parestesia posterior.
También se comentan observaciones de laboratorio sobre la variación del pH de varias soluciones de anestésicos locales (AL) luego de la adición de NaHCO3 y los hallazgos histopatológicos en cortes de médula espinal de caninos medicados con lidocaína alcalinizada por vía intratecal.
Informe de casos
Caso 1. Mujer de 58 años ASA-P clasificación I, de
Caso 2. Mujer de 34 años (G-3, P-2) con embarazo de 37 semanas, programada para ser sometida a una segunda operación cesárea. La primera intervención se había realizado bajo anestesia espinal, 4 años antes. La paciente, de
Observaciones de laboratorio
Se determinó la variación del pH de distintos anestésicos locales luego de la adición de NaHCO3 al 8.49%. Se utilizaron como base los siguientes compuestos a los que se les agregó distintos volúmenes de la solución de NaHCO3: lidocaína al 1 y 2% (con y sin epinefrina); bupivacaína al 0.5% (con y sin epinefrina); ropivacaína al 0.2% y levobu-pivacaína al 0.5%. Las mediciones se efectuaron con un pHmetro (Hanna Instruments, Woonsocket, RI de resolución 0,01 e intervalo de pH de
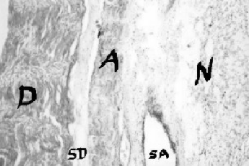
Por otra parte, se obtuvieron datos de las secciones histológicas de médulas espinales, obtenidas dos y catorce días postratamiento, de dos caninos que recibieron por vía intratecal 2ml de una solución alcalinizada de lidocaína al 1% preparada de la siguiente manera: 1 mEq de NaHCO3 (1 ml) cada 10 ml de lidocaína 1%. Las secciones histológicas obtenidas 14 días después de la inyección permitieron observar la acumulación de las raíces del nervio lumbar (Figura 3).
Discusión
Comentarios de los casos clínicos
Caso 1. Una primera punción intratecal accidental permeabilizó la duramadre comunicando el espacio espinal con el epidural. Es probable que el intento de colocar el catéter, durante la segunda punción, haya sido infructuoso debido a que la punta de la aguja se encontraba en contacto con la pared dural y que la rotación de la aguja haya agravado la situación. Se ha observado que una rotación superior a los 280º disminuye considerablemente la fuerza necesaria para atravesar la duramadre3, 4 contribuyendo a la permeabilidad del espacio espinal. El acceso accidental al espacio subaracnoideo, evidenciado por la sensación de parestesia descripta por la paciente durante la primera punción debe haber lesionado alguna raíz nerviosa lo cual contribuyó a la evolución del cuadro clínico.
La realización del procedimiento con la paciente en posición sentada, favoreció la difusión del preparado hacia el compartimiento subaracnoideo. Este fenómeno se ve favorecido por la mayor osmolaridad de las soluciones alcalinizadas lo cual a su vez propicia la acumulación de la solución en el nivel espinal inferior, explicando la acumulación de las raíces de los nervios en los niveles L4, L5 halladas en
Caso 2. Los estudios de RM han observado que en general las raíces nerviosas lumbares flotan libremente en el LCR; por ello, cuando los pacientes son colocados en posición decúbito lateral y debido a la acción de la gravedad, esas raíces están mayormente en el lado dependiente7; por lo tanto, es probable que un abordaje paramedial izquierdo provoque parestesia en la extremidad inferior izquierda. El inmediato dolor de cabeza sugiere que hubo punción del saco dural y que el aire inyectado durante la prueba de falta de resistencia produjo un neumoencéfalo. La dosis de gabapentina empleada fue insuficiente ya que para revertir la reacción aracnoidea inflamatoria se recomiendan dosis superiores, administradas en forma conjunta con esteroides, para aliviar los síntomas6.
Los primeros intentos para disminuir el periodo de latencia de los anestésicos locales en la anestesia neuroaxial se basaron en las observaciones de laboratorio realizadas por Oscar Gros8 en 1910, quien postuló que “la parte activa de una AL era su base libre liberada, lo que permitía que una mayor cantidad de procaína entrase en el nervio cuando ella era liberada de una solución carbonatada en vez de una sal de hidrocloruro. Arthur Laewen9 observó que se producía un bloqueo más duradero cuando se adicionaba bicarbonato a la procaína, al tiempo que se reducía su toxicidad10.
La popularidad de esta combinación ha variado de acuerdo con la preferencia del anestesiólogo. Las soluciones recomendadas2 incluían mezclas que contenían 1mEq de NaHCO3 en 10 ml de lidocaína o mepivacaína y 0,1mEq de NaHCO3 en 20 ml de bupivacaína. Drasner et al12 informaron un caso de síndrome de cauda equina en un paciente que recibió lidocaína al 2% carbonatada, inyectada a través de un catéter que mostró pérdida de LCR cuando fue aspirado al final del procedimiento. Los autores atribuyeron la neurotoxicidad a la instilación subaracnoidea inadvertida de la solución (por migración del catéter), la cual sólo estaba aprobada para ser administrada por vía epidural.
Rowlingson11 propone que el rápido comienzo de acción de las soluciones de anestésicos alcalinizadas se debe a que la maniobra favorece la penetración del principio activo al interior de las raíces del nervio, aumentando así su concentración en el sitio de acción y con ella, la intensidad del bloqueo. La elevada concentración registrada a nivel radicular ha sido propuesta como un factor desencadenante de la lesión nerviosa13. Es sabido que la elevación del pH del medio en el que se encuentra el anestésico local incrementa la porción no ionizada del compuesto, que debido a su mayor liposolubilidad aumenta la biodisponibilidad intra-neuronal.
Es importante destacar que este fenómeno se encuentra limitado por la solubilidad de cada agente dado que precipitan por encima de un determinado pH, como quedara demostrado en nuestro ensayo.
Gentili et al14 descubrieron al estudiar a los anestésicos locales del grupo amida que las inyecciones intrafasciculares de lidocaína al 2% con bicarbonato fueron las responsables del mayor daño, equivalente al producido por los ésteres como la procaína al 2% y la tetracaína al 1%, mientras que la bupivacaína y la mepivacaína parecen tener el menor efecto neurotóxico. Estos autores postularon que después de pasar la barrera perineural (parestesia), la forma bicar-bonatada de la lidocaína al 2% producía degeneración axonal severa, lo cual no sucedía cuando se aplicaban inyecciones extrafasciculares o luego de la inyección intra-fasciculares de solución de NaCl 0,9%. Selander et al15 también afirmaron que cuando existe parestesia se aumenta la posibilidad de dañar al nervio, ya que la rápida difusión del CO2 liberado por la lidocaína bicarbonatada disminuye rápidamente el pH del fluido intersticial dentro del perineuro, este último lesionado durante la punción11.
Racle et al16 estudiaron el comportamiento de la administración intratecal de bupivacaína al 0.5% con el agregado de bicarbonato al 0.42% en pacientes geriátricos. En este estudio se adicionaron cada 20 ml del anestésico local, 0.2 ml de NaHCO3 al 0,42% o solución salina 0.9% según se tratara al grupo en estudio o control respectivamente. Los autores no encontraron diferencias significativas al comparar el período de latencia o la extensión del bloqueo sensitivo y motor de las soluciones empleadas. Tampoco se detectaron signos de déficit neurológico16.
Ha sido postulado que la adición de bicarbonato de sodio a las soluciones de anestésicos locales no sólo aumenta la biodisponibilidad del principio activo en el axoplasma sino que además puede potenciar la lesión axonal no solo por promover un incremento del pH sino también por aumentar la osmolaridad del medio. Cuando se incorpora 1mEq de NaHCO3 en 20 ml de lidocaína al 2% la tonicidad de la solución se incrementa de
A excepción del estudio mencionado16, los trabajos realizados analizan la inyección de anestésicos locales con el agregado de NaHCO3 por vía extradural. Ellos estipulan la dosis, el volumen y la concentración de la inyección, no especifican la dosis máxima tolerable, el rango de la dosis, la dosis mínima efectiva ni la relación eficacia/toxicidad. La posibilidad de que las soluciones que contienen NaHCO3 accedan al espacio subaracnoideo en forma accidental por un lado y la falta de ensayos controlados que evalúen la seguridad de su utilización en el canal vertebral por el otro, exige una conducta más prudente. Se deben poner en consideración también muchos de los específicos aprobados por
En una mirada retrospectiva de los casos analizados, podemos concluir que los intentos de acelerar el inicio de la anestesia pueden no haber sido justificados, ya que el comienzo del acto quirúrgico se ubicó más allá del período de latencia de las soluciones comerciales del anestésico empleado (20 y 16 minutos para el caso 1 y 2 respectivamente). Es evidente a la luz de los resultados que los aparentes beneficios no justificaban el riesgo.
Bibliografía
1. Catchlove RFH: The influence of CO2 and pH on local anesthetic action. J Pharmacol Exp Therap 1972:181:298-91.
2. Covino BG: Pharmacology of local anesthetic agents. Br J Anaesth 1986:58:701-16.
3. Meiklejohn BH: The effect of rotation of an epidural needle. Anaesthesia 1987:42:1180-2.
4. Angil PM, Kronberg JE, Thompson DE, Ackerley C, Szali JP, Duffin J, Faure P: Dural tissue trauma and CSF leak after epidural needle puncture. Anesthesiology 2003: 99:1376-82.
5. Avidan A, Gomori, Davidson E: Nerve root inflammation de-monstrated by MRI in a patient with transient neurologic symptoms after intrathecal injection of lidocaína. Anes-thesiology 2002:97:257-8.
6. Aldrete JA: Neurological deficit and arachnoiditis from neuroaxial anesthesia. Acta Anesthesiol Scand 2003:47:3-12.
7. Takigachi T, Yamaguchi S, Hashizume Y, Kitajima T: Movement of the cauda equina during the lateral decubitus position with fully flexed legs. Anesthesiology 2004:101:1250
8. Gros O: Uber eine Methode die anaesthesierende Wirkung der Lokal anaesthetica zu steigern. Munc med Wochenschr 1910:39:2042-3.
9. Läwen A: Über die Verwendung des Novokains in Natriumbi-carbonate-Kochsalzosungen zur localen Anaesthesie. Munch med Wochenschr 1910:39:1044-6.
10. Läwen A: Über Extraduralanaesthesie fur chirurgische Ope-rationen. Deutsche F. Chirurgie 1911:108:1-43.
11. Rowlingson JC: Toxicity of local anesthetic additives. Reg Anesth 1993:18:453-60
12. Drasner K, Rigler ML, Sessler DI, Stoller ML: Cauda equina syndrome following intended epidural anesthesia. Anesthe-siology 1992:77:582-5.
13. Myers RR, Olmaker K: Anatomy of DRG, intrathecal nerve roots and epidural nerves with emphasis on mechanisms of neurotoxicity. In Spinal Drug Delivery; T L Yaksh (ed). Elsevier Science BV Amsterdam 1999:pp.115-31.
14. Gentili F, Hudson AR, Hunter D, Kline DG: Nerve injection injury with local anesthetic agents: A light and electron microscopic fluorescent microscopic and horseradish peroxidase study. Neurosurgery 1980:6:263-72.
15. Selander D, Brattsand R, Lundborg G et al: Local anesthetics: Importance of mode of application, concentration and adrenaline for the appearance of nerve lesions. Acta Anaesthsiol Scand 1979:23:127-36.
16. Racle JP, Jourdren L, Benkhadra A, Poy JY, Fockeiner F: Effect of adding sodium bicarbonate to bupivacaine for spinal anesthesia in elderly patients. Anesth Analg 1988: 67:570-3.
*La levobupivacaína fue recientemente retirada del mercado.
TABLA I
pH de los anestésicos locales antes y después de la adición
de bicarbonato de sodio
|
Anestésico |
pH sin NaHCO3 |
pH con NaHCO3 |
mEq de NaHCO3 |
|
|
|
|
agregado |
|
Lidocaína 1% |
6.38 (0.02) |
7.64 (0.04) |
1.0 mEq/10 mL |
|
Lidocaína 1% +epi |
3.68 (0.50) |
7.32 (0.05) |
1.0 mEq/10 mL |
|
Lidocaína 2% |
5.49 (0.01) |
7.12 (0.05) |
1.0 mEq/10 mL |
|
Lidocaína 2% +epi |
3.62 (0.08) |
6.33 (0.03) |
1.0 mEq/10 mL |
|
Bupivacaína 0.5% |
5.16 (0.01) |
7.02 (0.02) |
0.1 mEq/10 mL |
|
Bupivacaína 0.5% +epi |
3.39 (0.02) |
5.85 (0.05)* |
0.1 mEq/10 mL |
|
Bupivacaína 0.25% +epi |
3.96 (0.02) |
7.16 (0.04) |
0.1 mEq/10 mL |
|
Ropivacaína 0.2% |
5.28 (0.01) |
7.03 (0.02)* |
0.05 mEq/10 mL |
|
Levobupivacaína 0.5% |
5.26 (0.01) |
6.30 (0.05)* |
0.05 mEq/10 mL |
Los datos se expresan como la media ± el error estándar.
* Se forma precipitado (turbidez)
Fig. 1.– Vistas axiales de una MRI de columna lumbar en las que se observan raíces de los nervios acumuladas, principalmente en el lado izquierdo del saco dural.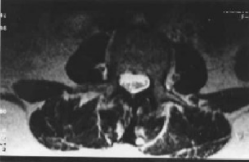
Fig. 2.– Vistas axiales de una MRI de columna lumbar en las que se observan la mayoría de las raíces de los nervios acumuladas y alineadas en una formación transversal asimétrica.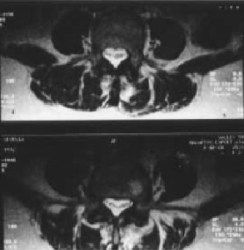
Fig. 3.– Sección histológica de una pared de saco dural gruesa inflamado (D), con una capa intermediaria de aracnoide (A) y de espacio subdural (sd) entre ambas. La raíz del nervio (N) está adherida a la dura y a otra raíz. Se representa el espacio subaracnoideo (sa); tinción H-E, x30.